Histología y la Histomorfometría, desde que, por los motivos por todos conocidos, comenzaron a ser cuestionados los agentes promotores de crecimiento y anticoccidianos de origen químico, en forma simultánea y paralela creció el interés de los técnicos y productores por conocer mejor los mecanismos que rigen la salud intestinal de las diversas especies.
Debíamos aprender la verdadera trascendencia del tracto intestinal en los procesos productivos:
• Microbiota.
• Bacterias benéficas.
• PH intestinal.
• Acción enzimática.
• Acción antiinflamatoria.
• Radicales libres.
• Inmunomodulación.
• Integridad.
• Relación vellosidad/cripta.
y tantos otros términos a los que agregamos últimamente el de biomarcadores, son hoy de uso y aplicación diarios en la lucha por mejorar la performance productiva de nuestras aves.
La búsqueda de alternativas al uso de antibióticos en forma no terapéutica como los promotores de crecimiento y anticoccidiales, nos ubica también en otra búsqueda, que es encontrar metodologías, que nos sirvan para la aplicación práctica en la evaluación de productos.
La graduación histológica de los tejidos se realiza utilizando un score para obtener datos semicuantitativos.
La validación del sistema de graduación debe considerar la repetitividad del tejido histológico a evaluar, para corroborar cambios morfológicos de lesiones que reflejen el compromiso funcional que tenga el órgano (cuadro 1) (Gibson, 2013).
Estos efectos pueden provocar una disminución de la absorción de los nutrientes, al aumentar el recambio celular y por ello necesitar mayor aporte de energía y proteínas para incrementar el crecimiento celular de las criptas que de esta manera se van profundizando (Miles, 2006; Sun, 2016).
Por lo mencionado, podemos decir que las criptas son la fábrica de las vellosidades y un incremento de las mismas es indicador del aumento en el recambio de la vellosidad asociado a una respuesta inflamatoria producida por patógenos, toxinas o ambos (Ginnenas, 2010; Awad, 2011).
La unidad vellosidad-cripta es una estructura altamente organizada. La cripta es la zona proliferativa que va a dar células hijas que se irán diferenciando a medida que migren a lo largo de la vellosidad, la cual se recambia cada 48 a 96 has, dependiendo el sitio anatómico y la edad del animal (Davison, 2008).
Las vellosidades están revestidas por enterocitos en diferentes estadios de maduración. La migración desde la cripta hasta la zona apical de la vellosidad es lo que hará que los enterocitos vayan madurando, hasta perderse por descamación fisiológica en el extremo de la vellosidad. Los enterocitos de la zona apical son los que tienen la mayor capacidad de absorción de los nutrientes.
La exfoliación de los enterocitos también llamada renovación puede verse afectada ante ciertos patógenos como los coccidios, que aumentarán la velocidad del recambio, llevando a que las vellosidades sean más cortas y las criptas más grandes, con una consecuente menor superficie de absorción (Ducatelle, 2018).
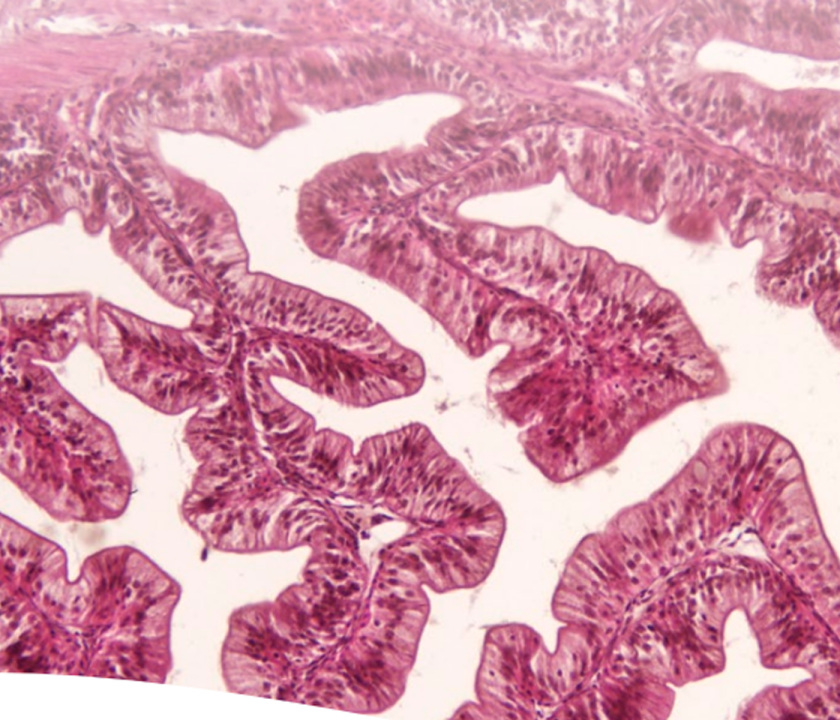
En la histomorfometría intestinal se determina la longitud de las vellosidades, desde la zona apical hasta la muscular de la mucosa y la profundidad de las criptas, para posteriormente calcular la relación vellosidad– cripta (fotografía 1).
Fotografía 1. Histomorfometría. Longitud de las vellosidades (flecha roja), profundidad de las criptas de Lieberkühn (flecha amarilla) teñido con Hematoxilina & Eosina.
Para la evaluación cuantitativa puede utilizarse el programa Image J. La relación vellosidad-cripta es un indicador importante. Cuando disminuye, refleja la pérdida de los enterocitos maduros con la consecuente hiperplasia del epitelio de las criptas, por la necesidad de reemplazar esos enterocitos maduros que se perdieron (Abdul-Aziz, 2016).
Finalmente podemos concluir que la histopatología y la histomorfometría resultan métodos de estudio complementarios de aplicación práctica para evaluar el estado sanitario e inmunitario frente a posibles emergentes infecciosos de presentación subclínica.
Es importante por ello, obtener y utilizar productos Poliherbales como:
PeptaSan®, cuyos compuestos fito-activos con actividad frente a los protozoos, antioxidante e inmunomoduladora, favorecen la protección de la mucosa intestinal frente a la acción de enteropatógenos como las eimerias y los Radicales libres, propiciando una mucosa intestinal con menor inflamación y mayor relación vellosidad–cripta, siendo por este motivo una alternativa para asegurar una mejor absorción de los nutrientes con el menor gasto de energía en montar una respuesta inflamatoria ante todo tipo de agresiones.
Posicionamiento: Contribuye al equilibrio de la microbiota intestinal y favorece la respuesta del sistema inmune.
Referencias:
– Abdul-Aziz T., Fletcher O., Barnes H.J. Avian Histopathology, 4th edition publish by American Association of Avian Pathology, 2016.
– Awad WA, Buhm J, Razzazi- Fazeli, Ghareeb K, and Zentek J., “Effect of Addition of Probiotic Microorganism to Broiler Diets Contaminanted with Deoxynivalenol on Perfomance and Histological Alterations of Intestinal villi of Broiler Chikens”. Poultry Science 85:974-979. 2006.
– Choct M., Managing gut health through nutrition. British Poultry Science. Volume 50, Number 1, pp.9-15,January. 2009.
– Davison F, Kasper B, Schat K. Avian Immunity. Ed. Elsevier 1st ed. 2008.
– De Franceschi M, Pinto S. Iglesias B. “Estrategias para evaluar alternativas a los promotores de crecimiento”. XXII Congreso Latinoamericano de Avicultura, Buenos Aires, 2011.
– Ducatelle Richard., Evy Goossens, Fien De Meyer, Venessa Eeckhaut, Gunther Antonissen, Freddy Haesebrouck and Filip Van Immersee. Review Biomarkers for monitoring intestinal health in poultry: present status and future perspectives. Vet. Res. 49:43 https://doi.org/10.1186/s13567-018-0538-6, 2018.
– Gibson-Corley KN, Olivier AK, and Meyerholz DK. Principles for Valid Histopathologic Scoring in Research K. N. Veterinary Pathology, 50(6) 1007-1015. 2013.
– Giannenas I, Tontis D, Tsalie E, Chronis F, Doukas D, Kyriazakis I. Influence of dietary mushroom agaricus bisporus on intestinal morphology and microflora composition in broiler chickens. Res. Vet. Sci. 89:78-84. 2010.
– Hu Z, Guo Y. Effects of dietary sodium butyrate suplementation on the intestinal morphological structure, absoptive function and gut flora in chickens. Anim. Feed Sci. Technol. 132:240-249. 2007.
– Lan Y., Verstegen W.A., Tamminga S. and Williams B.A. The role of the commensal gut microbial community in broiler chickens, World’s Poultry Science Journal, Vol. 61, 95-104, March 2005.
– Miles R.D., G. D. Butcher, P. R. Henry, and R. C. Littell. Effect of Antibiotic Growth Promoters on Broiler Performance, Intestinal Growth Parameters, and Quantitative Morphology. Poultry Science, 85:476-485, 2006.
– Pinto Silvina, Ernesto Vignoni, Cecilia Esquivel, Florencia Prosdócimo, Romina Mitarotonda, Natalia Cerny, Hebe Barrios, Mauricio De Franceschi, Mauricio de Marzi “Acción de promotores de crecimiento sobre la mucosa intestinal de pollos parrilleros”. Revista de. Medicina. Veterinaria 101 (2): 07-16. ISSN 1852-771X. 2020.
– Qureshi S, Banday MT, Shakeel I, Adil S, Mir MS, Beigh YA, Amin U. Histomorphological studies of broiler chicken fed diets supplemented with either raw or enzyme treated dandelion leaves and fenugreek sedes. Veterinary World, EISSN: 2231-0916. 2016.
– Steiner T. Managing Gut Health. Nottingham University, Austria.2006.
– Sun Lili, Haibo Dong, Zhenchao Zhang, Jie Liu, Yun Hu, Yingdong Ni, Roland Grossmann, Ruqian Zhao. Activation of epithelial proliferation induced by Eimeria acervulina infection in the duodenum may be associated with cholesterol metabolism www.impactjournals.com/oncotarget/ Oncotarget, Vol. 7, No. 19. 2016.