INTRODUCCIÓN
Gallibacterium anatis en avicultura ha adquirido gran relevancia en los últimos años por su implicación directa en procesos respiratorios y reproductores. Las patologías respiratorias representan el principal problema infeccioso en las explotaciones avícolas de todo el mundo, no solo por sus efectos directos, sino también por consecuencias como la bajada de puesta y el empeoramiento de los índices de conversión.
Para realizar un diagnóstico completo, se deben tener en cuenta tanto los patógenos primarios como los agentes secundarios, capaces de agravar estos procesos infecciosos dificultando el diagnóstico y tratamiento.
Gallibacterium anatis (GA) ha sido considerado durante mucho tiempo uno de estos agentes secundarios. Sin embargo, cada vez hay más evidencia que apunta a su papel como posible patógeno primario.
ETIOLOGÍA
Gallibacterium anatis es una bacteria Gram negativa que presenta 2 biovares G. anatis haemolytica (GAH) y G. anatis anatis (GAA).
GAH se caracteriza por su acción hemolítica, y es considerado según algunos autores, como un patógeno potencial y oportunista, especialmente en gallinas, aunque puede encontrarse tanto en animales sanos como enfermos1 .
EPIDEMIOLOGÍA
GA se encuentra principalmente en gallinas, pero también se ha descrito en otras aves como pavos, gansos, patos, faisanes y perdices2 .
- Los pavos son menos susceptibles que otras aves y por ello esta especie podría actuar como reservorio y fuente de transmisión para otras galliformes.
- También se ha encontrado en mamíferos como caballo, oveja y conejo.
GA está distribuido mundialmente, pudiéndose aislar en todos los continentes, desde Europa y Asia, a Norteamérica y África.
La enfermedad se transmite por vía respiratoria por contacto directo entre animales sanos y enfermos, y por transmisión vertical a través de huevos infectados 2,6 mediante vía transovárica/oviducto o a través de la cáscara del huevo.
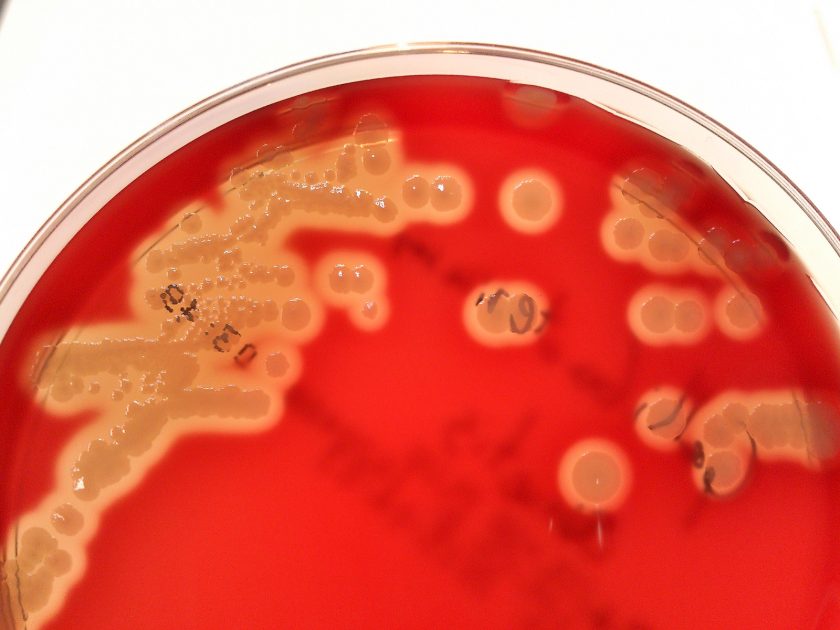
Imagen 1: Cultivo G. anatis haemolytica en Agar Sangre Columbia. Fuente Exopol S.L.
PATOGÉNESIS Síntomas y lesiones
La infección por GA no produce signos clínicos específicos o lesiones importantes.
La bacteria se adhiere a los receptores de las células epiteliales de las mucosas gracias a sus adhesinas y a partir de ese momento comienza a fabricar factores de virulencia.
Puede encontrarse de forma crónica en la tráquea y cloaca de animales sanos, formando parte de la microflora del tracto respiratorio superior y tracto genital inferior.
Sin embargo, también puede asociarse a lesiones clínicas como pericarditis, hepatitis, ooforitis, degeneración folicular, enteritis, salpingitis y peritonitis, que van a desembocar en una disminución de la puesta de hasta el 8-10% en ponedoras y un aumento de la mortalidad en reproductoras de entre 0,1-4,9%.
En muchas ocasiones se ha asociado a otros agentes como Escherichia coli (APEC), patógeno primario causante de salpingitis, siendo difícil valorar el papel patógeno desempeñado por GA o junto a otras especies bacterianas como Avibacterium paragallinarum, Mycoplasma gallisepticum y Mycoplasma synoviae, que pueden actuar como patógenos primarios.
También es frecuente su asociación con ciertos virus como Newcastle y Adenovirus.
Factores de virulencia
Los factores de virulencia más importantes identificados en GA son:
Fimbria F17-like
La bacteria se adhiere mediante estas fimbrias a las células epiteliales de las mucosas tanto del sistema respiratorio como reproductor.
Citotoxina GtxA
Es una proteína capaz de formar poros en la membrana plasmática de las células epiteliales destruyéndolas. También presenta capacidad inmunogénica, por lo que es un importante indicador para la selección de cepas vacunales.
Hemaglutinina
Algunas cepas pueden aglutinar hematíes de pollo y codorniz debido a la expresión de las hemaglutininas o adhesinas que se unen a los receptores de superficie.
Otros factores de virulencia identificados son la formación de biofilm, las metaloproteasas, las vesículas de membrana externa y el factor de elongación termoinestable.
DIAGNÓSTICO
La presencia de GA se puede confirmar mediante cultivo microbiológico a partir de órganos lesionados, principalmente tráquea, pulmón y oviducto.
Sin embargo, el diagnóstico por técnicas moleculares como qPCR es mucho más rápido y directo.
A partir de una identificación positiva de GA, se pueden detectar factores de virulencia como fimbria F17-like o GtxA, también por qPCR, y aunque la presencia de estos factores no implica necesariamente la patogenicidad de la bacteria, su ausencia sí determina su inocuidad.
ESTRATEGIAS DE CONTROL Y PREVENCIÓN
El tratamiento con antibióticos es la primera medida para combatir la infección una vez instaurada, pero debido a las restricciones actuales en el uso de antibióticos, la inmunoprofilaxis toma una especial relevancia.
Además, las cepas multirresistentes ya detectadas hacen más complicado su control4,11,12 .
Actualmente, no existe en nuestro mercado ninguna vacuna registrada frente a GA, por lo tanto, el uso de las autovacunas estaría indicado para hacer frente a esta infección.
Los estudios experimentales realizados con bacterinas, muestran altos niveles de anticuerpos en sangre en los animales vacunados y un aumento significativo de la producción de huevos.
SITUACIÓN EN ESPAÑA Y PORTUGAL. RESULTADOS EN LOS ÚLTIMOS AÑOS
Durante el periodo 2021-2023 se analizaron un total de 323 casos que corresponden a N=377 muestras clínicas remitidas al laboratorio Exopol S.L. de animales procedentes de España y Portugal con síntomas respiratorios, con bajada de puesta o controles sanitarios rutinarios correspondientes a gallinas ponedoras o recría destinadas a la puesta.
Las muestras tomadas fueron hisopos traqueales y órganos, tráqueas en su mayoría, que se analizaron en pooles de hasta 5 muestras en cada pool.
Todas las muestras o pooles se sometieron a un “Panel respiratorio” mediante qPCR para la identificación de Mycoplasma gallisepticum (MG), Mycoplasma synoviae (MS), Gallibacterium anatis (GA), Pasteurella multocida, Bronquitis Infecciosa Aviar (IBV), Laringotraqueitis Infecciosa (ILT), Metapneumovirus A y B (TRT), Ornithobacterium rhinotracheale (ORT) y Avibacterium paragallinarum (coriza).
Cabe destacar que el ensayo utilizado para identificar GA presenta como diana el gen gtxA, capaz de identificar la variante hemolítica responsable de su capacidad patógena.
Durante este periodo de 3 años, se pudo observar que la frecuencia de detección de GA fue alta (73-83%), muy similar a la frecuencia de detección de MS (77-83%) con porcentajes similares, seguido de IBV (46-74%).
En el caso de IBV, cabe destacar la alta tasa de vacunación, lo cual podría explicar el alto porcentaje detectado, ya que la qPCR no es capaz de diferenciar entre cepas de campo y vacunales. Lo mismo ocurre en el caso de MS, donde tampoco se diferencia entre estos dos tipos de cepas, aunque bien es cierto que la tasa de vacunación frente a este agente es mucho menor.
Si comparamos estos resultados con los obtenidos para GA, al no existir una vacuna comercial, es muy probable que la mayoría de estos casos se deban a una infección por cepa de campo potencialmente patógena.
Gallibacterium anatis como agente primario
En la Gráfica 2 se observa que GA se detectó solo en un 3% de los casos como único agente dentro del “Panel Respiratorio”.
Esto nos hace pensar en su papel secundario, donde sí presentaría relevancia, encontrándose asociado a otros patógenos en la mayoría de los casos.
En los casos en que GA apareció como único agente, los valores de Cq se encontraron en un rango de 29-37, a excepción de una de las muestras que presentó un Cq 26, que representa una carga media-baja del agente, dejando abierto su potencial como patógeno primario.
Tasa de resistencia a antibióticos. Resultados de granjas españolas
Los resultados descritos en otros países coinciden con los encontrados en Exopol durante el periodo 2019-2024, donde se estudió la resistencia y sensibilidad de cepas de GA procedentes de granjas españolas.
Un estudio realizado en Polonia en 2024 con cepas aisladas en gallinas ponedoras con síntomas reproductores y respiratorios, mostró que la prevalencia más alta de resistencia antibiótica se dio en el grupo de los macrólidos (tilmicosina, tilosina), con un 100% de resistencia de las cepas testadas, seguida de la eritromicina.
También se observó una alta resistencia frente a la tetraciclina (96,2%) y doxiciclina (46%).
Otro estudio realizado por Shabbir y cols. entre los años 2019 y 2021 en Estados Unidos, con cepas procedentes de broilers y ponedoras, mostró que las cepas de GA resultaron resistentes a la penicilina (98%), eritromicina (95%) y clindamicina (94%), siendo además el 100% de ellas resistentes a la tilosina.
Los datos obtenidos de las muestras en España revelan una menor tasa de resistencia comparada con otros países. Hay familias de antibióticos como los aminoglucósidos, anfenicoles o polimixinas, donde el porcentaje de cepas resistentes es muy bajo.
Sin embargo, sigue destacando la alta tasa de resistencia, sobre todo en el caso de la doxiciclina, lincomicina, enrofloxacino y flumequine, alcanzando porcentajes muy elevados, en torno al 96-100%.
Por tanto, es necesario realizar pruebas de sensibilidad antibiótica para poder valorar cuál es el tratamiento más indicado en cada caso y llevar un control de la evolución de las resistencias antibióticas de las granjas.
CONCLUSIONES
- Los resultados evidencian el alto nivel de detección de GA variedad hemolítica en los casos clínicos respiratorios de gallinas en la industria avícola española y portuguesa. Aunque no fue posible demostrar la asociación de este agente como patógeno primario, nuestros datos sugieren su importancia en la implicación sinérgica en casos de coinfección con otros patógenos respiratorios, principalmente MS e IBV.
- Considerando la presencia de GA tanto en animales sanos como enfermos, su identificación mediante ensayos de qPCR mejora significativamente la interpretación de los resultados obtenidos procedentes de muestras de casos clínicos. Es importante realizar un estudio general en la explotación para poder valorar de forma objetiva la presencia de GA y sus posibles consecuencias.
- Es conveniente controlar y disminuir el uso de antibióticos para no aumentar la tasa de resistencias hasta límites irreversibles, aunque la situación de España no es por el momento preocupante.
- Cabe destacar la importancia de un diagnóstico temprano y precoz, capaz de identificar los patógenos existentes en las explotaciones avícolas antes de que el proceso se instaure o se agrave con patologías secundarias.