- دجاج التسمين الحديث هو بالتأكيد أكثر مظاهر التقدم الجيني وضوحًا.
- أدت تدابير الانتقاء الوراثي والغذاء والصحة والإدارة التي نفذت بشكل مكثف إلى هذه النجاحات.
- ومع ذلك، من الضروري للإنتاج الحفاظ على الجهاز الهضمي في حالة جيدة.
- مع تقصير فترة نمو دجاج التسمين وتحسن كفاءة التغذية، تصبح الحاجة إلى برامج صحية وتغذوية محسنة أكثر وضوحًا.
- نظرًا لأن التغييرات أثناء نمو الأمعاء دقيقة، فغالبًا ما يتم تجاهلها، ومع ذلك تؤثر صحة الأمعاء على الصحة العامة والإنتاجية.
في الوقت الحالي، تتطلب أنظمة الإنتاج الحيواني بحثًا مستمرًا للحد من آثار الإجهاد والالتهاب المزمن لتحسين استخدام الطاقة من خلال إنتاج الحيوانات.
على الرغم من عدم وجود “حل سحري” لمنع الحالات متعددة العوامل المرتبطة بالإجهاد المزمن، إلا أن العديد من الدراسات تظهر تحسنًا في التوازن الميكروبي المعوي والتمثيل الغذائي وسلامة الأمعاء من خلال منتجات بديلة مثل:
- البروبيوتيكس
- البريبايوتكس
- الحوامض العضوية
- مستخلصات نباتية
- زيوت اساسية
- المعادن النزرة
هذا اتجاه علمي دولي، بسبب التأثيرات المضادة للالتهابات ومضادات الأكسدة والمناعة، وكذلك التحسن في سلامة الأمعاء.
إن استبدال المضادات الحيوية في أنظمة الإنتاج بمنتجات بديلة، وتحسين ممارسات الإدارة، والأمن الحيوي الصارم، والمكونات عالية الجودة، وغياب الأمراض (الميكوبلازما/السالمونيلا)، وبرامج التلقيح الفعالة هي استراتيجيات فعالة للأهداف الصحية والإنتاجية.
في هذا العمل، نركز على مراجعة التداعيات الكبيرة للإجهاد المزمن والالتهاب المعوي على صحة وأداء الطيور التجارية.
هندسة والعوامل الأساسية لجهاز الدجاج الهضمي
بالإضافة إلى امتصاص وهضم الماء والغذاء، يحتوي الجهاز المعوي على مجتمع ميكروبي متنوع ومعقد (Celluzzi وMasotti، 2016)، بالإضافة إلى الجهاز العصبي المعوي للميتازوانز يعتبر “الدماغ الثاني” للكائن الحي (Schneider والآخرون، 2019).
بالإضافة إلى هذا التعقيد في البنية والعلاقات الميكروبية، في الدجاج، يحتوي النسيج اللمفاوي المرتبط بالأمعاء على أعلى تركيز للخلايا المناعية في الكائن الحي، ما يدل على أهميته (Peralta والآخرون، 2017؛ Casteleyn والآخرون، 2010).
- علاوة على ذلك، يحتوي الجهاز الهضمي على أعضاء ليمفاوية أولية مثل جراب فابريسيوس، حيث تنشأ الخلايا الليمفاوية ب وتتكاثر؛ هذا المكون من النسيج اللمفاوي المرتبط بالأمعاء في أنواع الطيور ضروري لحماية الجهاز الهضمي (Bar-Shira والآخرون، 2003).
يمكن أن يؤثر الميكروبيوم المعوي على بيولوجيا المضيف والتغذية والمناعة والجهاز العصبي الصماوي (Dimitrov، 2011). يبدو أن وظيفة الجهاز الهضمي تتوسطها الأحماض الدهنية قصيرة السلسلة الناتجة عن التخمير البكتيري (Wu والآخرون، 2017)، والتواصل بين الكائنات الحية الدقيقة والخلايا العصبية (Megur والآخرون، 2020)، ونظام الغدد الصماء (Fukui والآخرون، 2018)، والجهاز المناعي (Maslowski وMackay، 2011) وتعديل الحاجز الظهاري المعوي (Sharma والآخرون، 2010).
- يتحكم الجهاز العصبي المعوي وشبكة الغدد الصماء في حركية الجهاز الهضمي والاضطراب في اضطرابات الجهاز الهضمي الوظيفية (Fukui والآخرون، 2018).
توجد الخلايا المعوية الصماء في جميع أنحاء ظهارة الجهاز الهضمي وتنتج العديد من الهرمونات (Gribble وReimann، 2019).
كانت أول هرمونات الجهاز الهضمي المكتشفة هي:
- غسترين
- سكريتين
- كوليسيستوكينين
- أنسولين
- غلوكاغون
تم تحديد أكثر من 50 هرمونًا أو ببتيدات نشطة بيولوجيًا، ما يجعل الجهاز الهضمي العضو الأساسي الذي يعرض أنشطة الغدد الصماء أو الغدد الصماء العصبية أو الغدد الصماء الذاتية أو نظير (Rao وWang، 2010؛ Gribble وReimann، 2017).
في الميتازوانز، تنتج خلايا الأمعاء المعوية، وهي مجموعة فرعية من العديد من الخلايا المعوية الصماء، 90% من السيروتونين الناقل العصبي (5-hydroxytryptamine) (Lund والآخرون، 2018).
تتحكم الميكروبات المعوية جزئيًا في إفراز السيروتونين والدوبامين والأوكسيتوسين والإندورفينات التي تنتجها الخلايا المعوية الصماء (Forsythe والآخرون، 2010؛ Liang والآخرون، 2014؛ Mayer والآخرون، 2014). هناك حكمة كبيرة في المثل القديم “المشاعر الغريزية”.
- يتأثر توازن صحة الأمعاء أو التوازن الداخلي بها بمحور ميكروبيوتا الدماغ الأمعاء، والجهاز المناعي، والإجهاد التأكسدي، والتغذية، والحاجز الظهاري المعوي، والعوامل الوراثية، والمواد المضافة إلى الأعلاف، مثل المكملات الغذائية (الرسم 1).
يؤثر الإجهاد والالتهاب المطول سلبًا على محور الكائنات الحية الدقيقة والدماغ، ما يسبب خلل الجراثيم ويعطل بروتينات الوصلات الضيقة مع النقل الجهازي للبكتيريا والمستضدات الأخرى (الرسم 2).
أثناء الإجهاد المزمن، ونتيجة لذلك، يتم تحويل طاقة النمو والتكاثر بعيدًا عن هذه الوظائف للحفاظ على الاستجابة الالتهابية. الدواجن ليست استثناءً من هذه القاعدة.
محور ما تحت المهاد والغدة النخامية والغدة الكظرية
- محور ما تحت المهاد والغدة النخامية والغدة الكظرية هو شبكة معقدة من التأثيرات المباشرة وتفاعلات التغذية الراجعة بين ثلاثة مكونات: ما تحت المهاد والغدة النخامية والغدة الكظرية فوق الكلى (Lu والآخرون، 2021).
- محور ما تحت المهاد والغدة النخامية والغدة الكظرية هو نظام عصبي صماوي مهم يتحكم في تفاعلات الإجهاد.
- وهو ينظم العديد من الأنظمة الفسيولوجية، بما في ذلك الهضم، والجهاز المناعي، والمزاج والعواطف، والحياة الجنسية، وتخزين الطاقة والإنفاق استجابة للمحفزات البيئية (Cohen والآخرون، 2006).
مسببات الأمراض والأمراض
- بشكل عام، يؤدي التلف المستمر أو وجود العوامل المسببة للأمراض إلى حدوث عملية إجهاد في الجهاز الهضمي، ما يزيد من الالتهاب، وبالتالي الإجهاد التأكسدي (Frederico والآخرون، 2007).
- من بين مسببات الأمراض المحتملة المختلفة في الجهاز الهضمي، يمكننا تضمين البكتيريا، وحتى البروتوزوا، والتي يمكن أن تسبب العدوى أضرارًا معوية شديدة، ما يسبب المرض وارتفاع معدلات الوفيات.
- في الدجاج، تعد Eimeria tenella إحدى مسببات الأمراض الأعماقية الأولية التي تؤثر سلبًا على النمو واستخدام الأعلاف والإنتاجية بسبب التهاب الأعور النخري النزفي (Soutter والآخرون، 2021).
- وهناك بروتوزون آخر يستهدف الأعور وهو Histomonas meleagridis، وهو سبب داء الأنسجة في الدجاج والديك الرومي، والذي يتم التحكم فيه تقليديًا بالزرنيخ في النظام الغذائي.
- تشمل بدائل مكافحة التهابات البروتوزوا إضافات الأعلاف وغيرها من المُعدلات المناعية والمواد المساعدة وتطوير اللقاح المؤتلف.
- لا توجد لقاحات تجارية متاحة لـ Histomonas meleagridis (Liebhart والآخرون، 2017).
- هناك حاجة لا يمكن إنكارها لتحديد حلول أكثر فعالية لتقليل تأثير داء كوكسيديا الدجاج وداء الهيستومون.
- ومع ذلك، لا تزال هناك حاجة إلى تضمين موارد حاسمة، ما يجعل التقدم السريع صعبًا.
تعتبر الالتهابات البكتيرية واحدة من الالتهابات الرئيسية المرتبطة بالتهاب الجهاز الهضمي، والتي بسبب عملية العدوى ووجودها، تعدّ محفزات للعمليات الالتهابية الحادة أو حتى المزمنة (Yamamoto والآخرون، 2013).
في نماذج الفئران، يتم مساعدة نمو السالمونيلا ، من المفارقات، من خلال الاستجابات الالتهابية الحادة للبكتيريا المسببة للأمراض في الأمعاء، حيث أن هناك زيادة في هجرة العدلات وإنتاج أنواع الأكسجين التفاعلية وأنواع النيتروجين التفاعلية نتيجة لعدوى السالمونيلا التي تعطل توازن الكائنات الحية الدقيقة (Winter والآخرون، 2010أ).
تؤدي الزيادة في الأكسجين الجزيئي في تجويف الأمعاء إلى استنزاف اللاهوائية المتعايشة المهمة مثل Bacteroidetes و Clostridiales، وهي بكتيريا أساسية منتجة لحمض الزبد (Rigottier-Gois، 2013).
إن أكسدة الثيوكبريتات إلى تيتراثيونات هي أيضًا منتج ثانوي لأنواع الأكسجين التفاعلية (Winter والآخرون، 2010ب). في نماذج الفئران، تبين أن السالمونيلا تستخدم تتراثيونات لتعزيز تطورها (Winter والآخرون، 2010ب)؛ مرق تتراثيونات هو أحد مكونات الوسائط المخصبة لثقافة السالمونيلا في المختبرات التشخيصية.

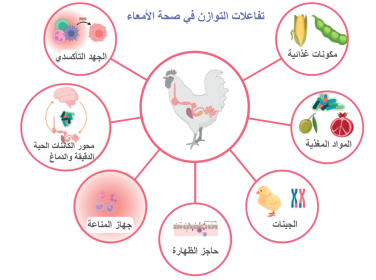
الرسم 1. التفاعلاتبين المضيف (أنواع الدواجن) والعوامل الداخلية أو الخارجية التي تؤثر على صحة الأمعاء (تم إنشاؤها باستخدام BioRender.com).
ومع ذلك، وجدت دراسة حديثة أن هذا يختلف بالنسبة للدجاج (Saraiva والآخرون، 2021).
- على النقيض من نماذج الفئران، في الدواجن، لا يبدو أن جينات ttrA وpduA تمثل محددات ضراوة كبيرة في إفراز البراز للغزو بالنسبة للسالمونيلا المعوية والسالمونيلا تيفيموريوم.
ومن المثير للاهتمام أن حذف كلا الجينين لا يخفف من العامل الممرض ولكنه يقلل قليلاً من أعداد السالمونيلا المعوية والسالمونيلا تيفيموريوم في الأعور في الدواجن، ما يقلل من الالتهاب ويسمح للبكتيريا بغزو الخلايا الظهارية المعوية بسهولة أكبر والانتشار بشكل منهجي، مما يؤدي إلى علامات سريرية شديدة ومعدلات وفيات أعلى (Saraiva والآخرون، 2021).
- أنواع الطيور فريدة من نوعها لأنها تفتقر إلى المثانة البولية، والإفرازات الكلوية تصل إلى الجهاز الهضمي مباشرة.
- يحتوي كل من الديك الرومي والدجاج على مذرق أو مسار إفرازي مشترك (Goldstein، 2006).
- على عكس الثدييات، حيث تنظم الكلى تكوين السائل خارج الخلية بشكل مستقل، يتدفق البول إلى المذرق في الطيور عن طريق عمل تمعجي عكسي إلى الأعور (Karasawa وDuke، 1995؛ Duke، 1999).
- وبالتالي، يجب أن تنظم الكلى والجهاز الهضمي السفلي تكوين السائل خارج الخلية. هنا، يقوم أعور الطيور بإعادة امتصاص الماء، وهضم الألياف (عن طريق التخمير البكتيري)، وإعادة تدوير النيتروجين، وتوليف الفيتامينات الميكروبية، والتنظيم التناضحي (Duke، 1982؛ Duke والآخرون، 1983؛ Hall وDuke، 2000).
- يمكن أن تؤثر التركيبة الغذائية على الرطوبة في فضلات البراز.
- يؤثر المحتوى المائي للبراز بشكل مباشر على رطوبة الفراش في أنظمة إنتاج الدواجن، مع مستويات رطوبة تتراوح من 15% إلى 44%.
- يحتوي فراش الدواجن على مستويات عالية من البروتينات والنيتروجين (Kelleher والآخرون، 2002). تتمثل إحدى المشكلات المهمة في فراش الدواجن في فقدان النيتروجين، مثل الأمونيا، أثناء التخمير الميكروبي لليوريا وحمض اليوريك (Nuhm، 2003).
- في بيوت الدجاج، يعد تطاير الأمونيا أحد أكثر الغازات إرهاقًا للدواجن التي تؤثر بشدة على رفاهية الطيور وصحتها وأدائها (Moore والآخرون، 2011؛ van der Hoeven-Hangoor والآخرون، 2014).
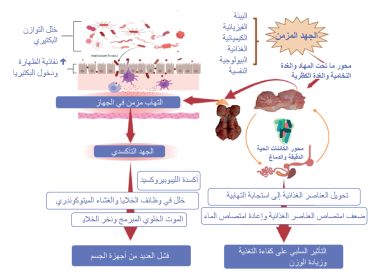
الرسم 2. الإجهاد المزمن (بغض النظر عن مصدره) له تأثير مباشر على محور ما تحت المهاد والغدة النخامية والغدة الكظرية، ومحور الدماغ والميكروبات والأمعاء، والغدد الصماء والجهاز المناعي. تنشأ الالتهابات الجهازية المعوية والمزمنة من اضطرابات في التوازن الدقيق وبيئة الكائنات الحية الدقيقة المعوية (خلل الجراثيم) والتغيرات في بروتينات الوصلات الضيقة بين الخلايا المعوية التي تسبب تسرب الأمعاء. يسبب الإجهاد التأكسدي المطول الناجم عن العملية الالتهابية بيروكسيد الفوسفوليبيد في أغشية الخلايا والميتوكوندريا، مما يؤدي إلى موت الخلايا المبرمج والنخر الخلوي وفشل الأعضاء المتعددة (تم إنشاؤه باستخدام BioRender.com).
عاصفة السيتوكينات NF – kB TNFA الدفاعية
- الأنماط الجزيئية المرتبطة بالمرض هي عناصر من البكتيريا المسببة للأمراض التي تتعرف عليها الميتازونات.
- تشمل الأنماط الجزيئية المرتبطة بالمرض الببتيدات الدهنية والببتيدوجليكان وأحماض التيشويك (Salminen وIsolauri، 2006).
- يعتبر عديد السكاريد الدهني الذيفان الداخلي، الموجود في الأغشية الخارجية للبكتيريا سالبة الجرام، مثالًا كلاسيكيًا (Kallapura والآخرون، 2014).
- بشكل عام، تحفز العوامل المعدية (البكتيرية، والبروتوزولية، والفيروسية، والديدان الطفيلية) استجابات المضيف المؤيدة للالتهابات.
- على سبيل المثال، في الدواجن المنزلية، قد يسبب الكوكسيديا نخرًا والتهابًا في الأمعاء، ما يؤدي إلى الحمى والاكتئاب وانخفاض الأداء والوفاة بسبب أنواع الـEimeria.
أنواع الأكسجين التفاعلية وأنواع النيتروجين التفاعلية وتأثيرهما على المستوى الجزيئي
- تحارب الكريات البيضاء والبلعميات متعددة الأشكال مسببات الأمراض كخط دفاع أول من خلال إنتاج جزيئات تفاعلية قادرة على إحداث تفاعلات الأكسدة أو الاختزال (Qureshi، 2003؛ Petrone-Garcia والآخرون، 2021).
- وتشمل أنواع الأكسجين التفاعلية هذه، الأكسيد الفائق، وبيروكسيد الهيدروجين، وجذور الهيدروكسيل.
- تتكون أنواع النيتروجين التفاعلية من أكسيد النيتريك وجزيئات البيروكسينيتريت.
- كل من أنواع الأكسجين التفاعلية وأنواع النيتروجين التفاعلية شديد السمية لمحاربة الغزاة.
- يمكن أن تخترق جدار الخلية الميكروبية بسهولة، ما يتسبب في ضرر لا رجعة فيه (Gostner والآخرون، 2013).
- تبدأ الإشارات المناعية فقط في إنتاج جزيئات ROS و RNS هذه لاعتراض مسببات الأمراض وقتلها (صن وآخرون، 2020).
- ومع ذلك، عندما تتفاعل جزيئات أنواع الأكسجين التفاعلية بشكل مفرط، فإنها تصبح سموم مناعية قادرة على إتلاف الخلايا المضيفة والأنسجة المجاورة، ما يؤدي إلى التهاب موضعي وجهازي شديد وفشل الأعضاء المتعددة (Chen وKevil، 2020).
- ونتيجة لذلك، فإن سيطرتها هي المفتاح لتجنب التأثير السلبي بسبب الإفراط في إنتاجها وتأثيرها السلبي (Lian والآخرون، 2020).
🔒 محتوى حصري للمستخدمين المسجلين.
سجّل مجانًا للوصول إلى هذا المنشور والعديد من المحتويات المتخصصة الأخرى. لن يستغرق الأمر سوى دقيقة وستحصل على وصول فوري.
تسجيل الدخولسجل في aviNews
يسجل







