Konten ini tersedia dalam: English Melayu (Malay) ไทย (Thai) Tiếng Việt (Vietnamese) Philipino
Ayam pedaging modern tentu saja merupakan manifestasi paling nyata dari kemajuan genetik.
- Seleksi genetik, pakan, kesehatan, dan tindakan pengelolaan yang dilakukan secara intensif telah menghasilkan keberhasilan ini.
- Namun, sangat penting untuk menjaga saluran pencernaan (GIT) dalam kondisi baik agar produksi dapat berjalan dengan baik.
- Seiring dengan semakin pendeknya masa pemeliharaan ayam pedaging dan peningkatan efisiensi pakan, kebutuhan akan program kesehatan dan gizi yang lebih baik menjadi lebih jelas.
- Karena perubahan selama pertumbuhan usus sangat kecil, perubahan tersebut sering kali diabaikan, padahal kesehatan usus memengaruhi kesehatan dan produktivitas secara umum.
Saat ini, sistem produksi ternak memerlukan pencarian terus-menerus untuk mengurangi dampak stres dan peradangan kronis guna meningkatkan penggunaan energi dengan memproduksi ternak.
Meskipun tidak ada “solusi ajaib” untuk mencegah kondisi multifaktorial yang terkait dengan stres kronis, beberapa penelitian menunjukkan peningkatan keseimbangan mikroba usus, metabolisme, dan integritas usus melalui produk alternatif seperti:
- Probiotik
- Prebiotik
- Asam organik
- Ekstrak tanaman
- Minyak esensial
- Trace mineral
Hal ini merupakan tren ilmiah internasional, karena efek anti-inflamasi, antioksidan, dan imunomodulatori, serta peningkatan integritas usus.
Penggantian antibiotik dalam sistem produksi dengan produk alternatif, praktik manajemen yang lebih baik, biosekuriti yang ketat, bahan-bahan berkualitas, tidak adanya penyakit (Mikoplasma/Salmonella), dan program imunisasi yang efektif merupakan strategi yang efisien untuk mencapai tujuan kesehatan dan produktivitas.
Dalam tulisan ini, kami fokus pada peninjauan dampak signifikan stres kronis dan peradangan usus terhadap kesehatan dan kinerja unggas komersial.
ARSITEKTUR DAN PELAKU SALURAN GASTROINTESTINAL AYAM
Selain menyerap dan mencerna air dan pakan, saluran usus mengandung komunitas mikroba yang beragam dan kompleks (Celluzzi dan Masotti, 2016), serta sistem saraf enterik (ENS) metazoa yang dianggap sebagai “otak kedua” organisme (Schneider et al., 2019).
Selain kompleksitas dalam struktur dan hubungan mikroba ini, pada ayam, jaringan limfoid terkait usus (GALT) mengandung konsentrasi sel imun tertinggi dalam organisme, yang menunjukkan relevansinya (Peralta et al., 2017; Casteleyn et al., 2010).
- Lebih jauh, sistem pencernaan memiliki organ limfoid primer seperti bursa Fabricius, tempat limfosit B berasal dan berkembang biak; komponen GALT pada spesies unggas ini penting untuk melindungi sistem pencernaan (Bar-Shira et al., 2003).
Mikrobioma usus dapat memengaruhi biologi inang, nutrisi, imunitas, dan sistem neuroendokrin (Dimitrov, 2011). Fungsi GIT tampaknya dimediasi oleh asam lemak rantai pendek (SCFA) yang dihasilkan oleh fermentasi bakteri (Wu et al., 2017), komunikasi antara mikrobiota dan neuron (Megur et al., 2020), sistem endokrin (Fukui et al., 2018), sistem imun (Maslowski dan Mackay, 2011) dan modulasi penghalang epitel usus (Sharma et al., 2010).
- ENS dan jaringan usus endokrin mengendalikan motilitas GIT dan gangguan pada gangguan GIT fungsional (Fukui et al., 2018).
Sel enteroendokrin (EEC) ditemukan di seluruh epitel GIT dan menghasilkan beberapa hormon (Gribble dan Reimann, 2019).
Hormon GIT pertama yang ditemukan adalah:
- Gastrin
- Secretin
- Cholecystokinin
- Insulin
- Glucagon
Lebih dari 50 hormon atau peptida bioaktif telah diidentifikasi, menjadikan GIT sebagai organ utama yang menampilkan aktivitas endokrin, neuroendokrin, autokrin, atau parakrin (Rao dan Wang, 2010; Gribble dan Reimann, 2017).
Pada metazoa, sel enterokromafin usus, subpopulasi dari banyak EEC, menghasilkan 90% neurotransmitter serotonin (5-hidroksitriptamin) (Lund et al., 2018).
Mikrobiota usus sebagian mengendalikan sekresi serotonin, dopamin, oksitosin, dan endorfin yang diproduksi oleh EEC (Forsythe et al., 2010; Liang et al., 2014; Mayer et al., 2014). Ada hikmah besar dalam pepatah lama “perasaan hati”.
- Keseimbangan kesehatan usus atau homeostasis dipengaruhi oleh sumbu mikrobiota-otak-usus, sistem imun, stres oksidatif, nutrisi, penghalang epitel usus, faktor genetik, dan aditif pakan, seperti nutraceuticals (Gambar 1).
Stres dan peradangan berkepanjangan berdampak negatif pada sumbu mikrobiota-otak, menyebabkan disbakteriosis dan mengganggu protein sambungan ketat dengan translokasi sistemik bakteri dan antigen lainnya (Gambar 2).
Selama stres kronis dan, sebagai akibatnya, peradangan usus kronis, energi untuk pertumbuhan dan reproduksi dialihkan dari fungsi-fungsi ini untuk mempertahankan respons peradangan. Unggas tidak terkecuali dalam aturan ini.
Sumbu HPA
- Sumbu hipotalamus-hipofisis-adrenal (sumbu HPA) adalah jaringan kompleks pengaruh langsung dan interaksi umpan balik antara tiga komponen: hipotalamus, kelenjar pituitari, dan kelenjar adrenal di atas ginjal (Lu et al., 2021).
- Sumbu HPA adalah sistem neuroendokrin penting yang mengendalikan reaksi stres.
- Sumbu ini mengatur banyak sistem fisiologis, termasuk pencernaan, sistem kekebalan tubuh, suasana hati dan emosi, seksualitas, serta penyimpanan dan pengeluaran energi sebagai respons terhadap rangsangan lingkungan (Cohen et al., 2006).
PATOGEN DAN PENYAKIT
- Secara umum, kerusakan konstan atau keberadaan agen patogen memicu proses stres di GIT, meningkatkan peradangan dan, oleh karena itu, stres oksidatif (Federico et al., 2007).
- Di antara berbagai patogen yang mungkin ada di GIT, kita dapat memasukkan bakteri, dan bahkan protozoa, yang infeksinya dapat menyebabkan kerusakan enterik yang parah, menyebabkan penyakit dan tingkat kematian yang tinggi.
- Pada ayam, Eimeria tenella merupakan patogen sekum primer yang berdampak negatif pada pertumbuhan, pemanfaatan pakan, dan produktivitas karena tiflitis nekro-hemoragik (Soutter et al., 2021).
- Protozoa lain yang menargetkan sekum adalah Histomonas meleagridis, penyebab histomonosis pada ayam dan kalkun, yang secara tradisional dikendalikan dengan arsenik dalam pakan.
- Alternatif untuk mengendalikan infeksi protozoa meliputi aditif pakan dan imunomodulator lainnya, adjuvan, dan pengembangan vaksin rekombinan.
- Tidak ada vaksin komersial yang tersedia untuk H. meleagridis (Liebhart et al., 2017).
- Ada kebutuhan yang tidak dapat disangkal untuk mengidentifikasi solusi yang lebih efektif untuk mengurangi dampak koksidiosis dan histomonosis pada ayam.
- Namun, sumber daya penting masih perlu disertakan, sehingga kemajuan yang cepat menjadi sulit.
Infeksi bakteri dianggap sebagai salah satu infeksi utama yang terkait dengan GIT, yang karena proses dan keberadaan infeksinya, merupakan pemicu proses inflamasi akut atau bahkan kronis (Yamamoto et al., 2013).
Dalam model murine, pertumbuhan Salmonella dibantu, ironisnya, oleh respons peradangan akut terhadap bakteri patogen di usus, karena ada peningkatan migrasi neutrofil dan produksi spesies oksigen reaktif (ROS) dan spesies nitrogen reaktif (RNS) sebagai akibat dari infeksi Salmonella yang mengganggu keseimbangan mikrobiota (Winter et al., 2010a).
Peningkatan oksigen molekuler di lumen usus menguras anaerob komensal penting seperti Bacteroidetes dan Clostridiales, yang merupakan bakteri penghasil asam butirat esensial (Rigottier-Gois, 2013).
Oksidasi tiosulfat menjadi tetrationat juga merupakan produk sampingan ROS (Winter et al., 2010b). Dalam model murine, telah ditunjukkan bahwa Salmonella menggunakan tetrationat untuk memperkuat perkembangannya (Winter et al., 2010b); kaldu tetrationat merupakan komponen media yang diperkaya untuk kultur Salmonella di laboratorium diagnostik.

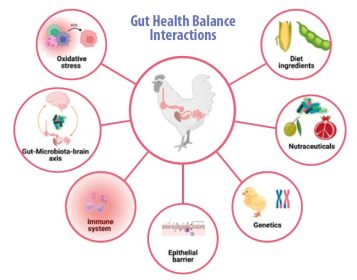
Gambar 1. Interaksi antara inang (spesies unggas) dan faktor intrinsik atau ekstrinsik yang mempengaruhi kesehatan usus (dibuat dengan BioRender.com).
Namun, penelitian terbaru menemukan bahwa hal ini berbeda pada ayam (Saraiva et al., 2021).
- Berbeda dengan model murine, pada unggas, gen ttrA dan pduA tampaknya bukan penentu virulensi yang signifikan dalam ekskresi feses yang bersifat invasif untuk Salmonella Enteritidis dan Salmonella Typhimurium.
Menariknya, penghapusan kedua gen tersebut tidak melemahkan patogen tetapi sedikit menurunkan jumlah Salmonella Enteritidis dan Salmonella Typhimurium di sekum unggas, mengurangi peradangan dan memungkinkan bakteri untuk lebih mudah menyerang sel epitel usus dan menyebar secara sistemik, yang menyebabkan tanda-tanda klinis yang parah dan tingkat kematian yang lebih tinggi (Saraiva et al., 2021).
- Spesies unggas unik karena tidak memiliki kandung kemih dan cakram ginjal.
- Kalkun dan ayam memiliki kloaka atau jalur ekskresi yang sama (Goldstein, 2006).
- Tidak seperti mamalia, di mana ginjal mengatur komposisi cairan ekstraseluler secara independen, urin mengalir ke kloaka pada unggas melalui tindakan peristaltik terbalik ke sekum (Karasawa dan Duke, 1995; Duke, 1999).
- Dengan demikian, ginjal dan saluran cerna bagian bawah harus mengatur komposisi cairan ekstraseluler. Di sini, usus unggas melakukan penyerapan kembali air, pencernaan serat (dengan fermentasi bakteri), daur ulang nitrogen, sintesis vitamin mikroba, dan osmoregulasi (Duke, 1982; Duke et al., 1983; Hall dan Duke, 2000).
- Komposisi makanan dapat memengaruhi kadar air dalam kotoran.
- Kadar air dalam kotoran secara langsung memengaruhi kadar air litter dalam sistem produksi unggas, dengan kadar air berkisar antara 15% hingga 44%.
- Litter unggas mengandung protein dan nitrogen dalam kadar tinggi (Kelleher et al., 2002). Masalah signifikan pada litter unggas adalah hilangnya nitrogen, seperti amonia, selama fermentasi mikroba urea dan asam urat (Nahm, 2003).
- Di kandang ayam, penguapan amonia merupakan salah satu gas yang paling membebani unggas yang sangat mempengaruhi kesejahteraan, kesehatan, dan kinerja unggas (Moore et al., 2011; van der Hoeven- Hangoor et al., 2014).
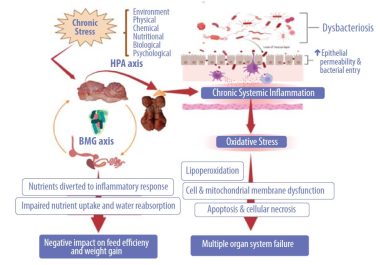
Gambar 2. Stres kronis (apa pun sumbernya) berdampak langsung pada aksis hipotalamus-hipofisis-adrenal (aksis HPA), aksis otak-mikrobiota-usus (aksis BMG), serta sistem endokrin dan imunologi. Peradangan sistemik kronis dan intestinal berasal dari gangguan keseimbangan dan lingkungan mikrobiota intestinal yang rapuh (disbakteriosis) dan perubahan protein tight junction di antara enterosit yang menyebabkan kebocoran usus. Stres oksidatif berkepanjangan yang disebabkan oleh proses inflamasi menyebabkan peroksidasi fosfolipid pada membran sel dan mitokondria, yang menyebabkan apoptosis, nekrosis seluler, dan kegagalan banyak organ (dibuat dengan BioRender.com).
PERTAHANAN NF-ΚB TNFA SITOKIN BADAI SITOKIN
- Pola molekuler terkait patogen (PAMP) adalah elemen bakteri patogen yang dikenali oleh metazoa.
- PAMP meliputi lipopeptida, peptidoglikan, dan asam teikoat (Salminen dan Isolauri, 2006).
- Endotoksin lipopolisakarida (LPS), yang ditemukan di membran luar bakteri Gram negatif, adalah contoh klasik (Kallapura et al., 2014).
- Secara umum, agen infeksius (bakteri, protozoa, virus, cacing) merangsang respons pro-inflamasi inang.
- Misalnya, pada unggas peliharaan, koksidiosis dapat menyebabkan nekrosis dan peradangan pada usus, yang mengakibatkan demam, depresi, penurunan kinerja, dan kematian tergantung pada Eimeria spp.
ROS DAN RNS DAN DAMPAKNYA PADA TINGKAT MOLEKULER
- Leukosit polimorfonuklear (PMN) dan makrofag melawan patogen sebagai garis pertahanan pertama dengan memproduksi molekul reaktif yang mampu memicu reaksi oksidasi atau reduksi (Qureshi, 2003; Petrone-Garcia et al., 2021).
- Ini termasuk ROS, seperti superoksida, hidrogen peroksida, dan radikal hidroksil.
- RNS terdiri dari molekul oksida nitrat dan peroksinitrit.
- ROS dan RNS sangat beracun untuk melawan penyerang.
- Mereka dapat menembus dinding sel mikroba dengan mudah, menyebabkan kerusakan yang tidak dapat dipulihkan (Gostner et al., 2013).
- Sinyal imun hanya memulai produksi molekul ROS dan RNS ini untuk mencegat dan membunuh patogen (Sun et al., 2020).
- Namun, ketika molekul ROS bereaksi berlebihan, mereka menjadi imunotoksin yang mampu merusak sel inang dan jaringan di sekitarnya, yang menyebabkan peradangan lokal dan sistemik yang parah dan kegagalan banyak organ (Chen dan Kevil, 2020).
- Oleh karena itu, pengendaliannya menjadi kunci untuk menghindari efek buruk karena produksi berlebih dan dampak negatifnya (Lian et al., 2020).