Para leer más contenidos de Avinews Mayo 2014
Por Javier Sanz Corella, Corporate Group Product Manager. HIPRA
El aMPV se aisló por primera vez en pavos en 1978 en Sudáfrica (Buys & Du Preez 1980). También a finales de los años 70, se reportó por primera vez en Sudáfrica casos de SHS (Síndrome de la cabeza hinchada) en pollos (Buys et al. 1989), al mismo tiempo que se reportaban los primeros casos de Rinotraqueítis de los pavos (Buys & Du Preez 1980).
Sin embargo no fue hasta 1987, cuando Picault et al. aislaron por primera vez el aMPV en un brote de Síndrome de cabeza hinchada en pollos. Siendo desde este momento una enfermedad en constante expansión, reportándose casos por todo el mundo.

Sólo se ha identificado un único serotipo, si bien se han diferenciado 4 subtipos mediante el análisis de la secuencia nucleotídica de la proteína de unión (G) (Juhasz & Easton, 1994) y pruebas de neutralización con anticuerpos monoclonales (Collins et al., 1993; Cook et al., 1993).
Naylor et al. (1997) demostraron como la exposición a un virus subtipo B sin atenuar evitó la sintomatología producida cuando se desafió posteriormente con subtipo A. Sin embargo, la misma experiencia con un subtipo A y posteriormente desafiado a un subtipo B, 2 de los 11 animales del estudio no mostraron protección. Estos resultados concuerdan con el de Eterradosi et al. (1995), asumiendo de esta manera una mejor inmunización con cepas subtipo B que con cepas subtipo A.
De la misma manera los subtipo B de campo causan cuadros clínicos más graves, y son el subtipo más prevalente a nivel europeo (Jones & Worthington, sin publicar).
La transmisión es horizontal, por contacto directo o indirecto con partículas eliminadas en aerosol por las aves enfermas (Jones et al., 1986; Cook et al., 1991; Panigrahy et al., 2000; Alkhalaf et al., 2002). La seroprevalencia en aves de producción es alta, aunque en pollos no siempre vaya acompañada de síntomas clínicos (O’Brien 1985; Hafez and Löhren 1990; Owoade et al. 2006).
El aMPV se replica en tracto respiratorio superior en aves de cualquier edad desde el momento del nacimiento (Hafez 1993; Cook 2000) y en el tracto reproductivo tras una fase de viremia.
Está asociado con las células de los epitelios ciliados de los cornetes nasales y tráquea, provocando una deformación y pérdida de los cilios en estas áreas lo cual facilita una mayor penetración de agentes secundarios (Majó et al. 1996) que complican y agravan el cuadro clínico.
Los signos clínicos en pollos de engorde se caracterizan por un cuadro respiratorio, a partir de los 20 días de edad, generalmente limitado al tracto respiratorio superior (tráquea y cornetes nasales). Estos síntomas se pueden caracterizar por estornudos, tos, destilación nasal, conjuntivitis y senos edematosos.
La infección causada por aMPV favorece el establecimiento y manifestación de infecciones respiratorias secundarias en pollos y pavos, como se ha demostrado con varios patógenos respiratorios (Naylor et al., 1992; Van de Zande et al., 2001; Marien et al., 2005; Van Loock et al., 2006).
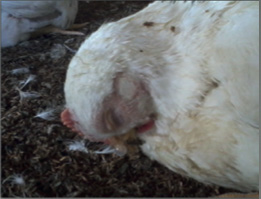
Foto 1 – Pollo de engorde 37 días con descarga nasal y edema infraorbitario

Foto 2 – Pollo de engorde 35 días, síndrome de cabeza hinchada

Foto 3 – Edema subcutáneo en caso de síndrome de la cabeza hinchada sin complicación bacteriana
Las reproductoras y ponedoras muestran la misma sintomatología clínica que los pollos a nivel respiratorio, solo que también son susceptibles de sufrir una replicación viral a nivel del oviducto tras una fase de viremia, sufriendo caída de la puesta, y afectación de la calidad de la cáscara del huevo, también podemos llegar a identificar sintomatología nerviosa, tortícolis y opistótonos, sobre todo en reproductoras pesadas, debido a infecciones bacterianas secundarias que producen una osteomielitis en la estructura ósea de la cabeza.
Las infecciones secundarias y las condiciones de manejo inapropiadas son determinantes para determinar la gravedad de los brotes. En todas las aves de producción, el estrés productivo supone un factor desencadenante de la mayoría de los cuadros clínicos (subida a pico en ponedoras y reproductoras, engorde a alta densidad, momentos de alta relación de kg pollo vivo / m2 nave).
El diagnóstico clínico no es 100% fiable, solo puede ser utilizado como una guía de aproximación al diagnóstico definitivo, este deberá alcanzarse mediante la interpretación de pruebas laboratoriales, principalmente serología, y como confirmatorio en casos dudosos, mediante el uso del diagnóstico molecular, si bien es complicado debido al breve periodo en el que podemos localizar el virus en el tejido y la baja sintomatología que manifiestan durante estos momentos (Baxter-Jones & Jones, 1989; Alexander 1991; Majó et al. 1995).
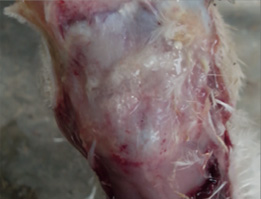
Foto 4. Edema subcutáneo en el caso de síndrome de la cabeza hinchada sin complicación bacteriana
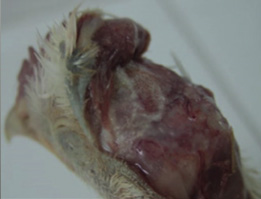
Foto 5. Edema subcutáneo en caso de síndrome de la cabeza hinchada con complicación bacteriana.
A continuación señalaremos unos puntos clave para el éxito de nuestros programas de control del aMPV.
TIPOS DE VACUNAS
Las vacunas vivas deben estimular principalmente la inmunidad locaL
Las vacunas inactivadas son esenciales para las aves de ciclo largo, es decir, deben ejercer un recuerdo sobre los tejidos vacunados con las vacunas vivas, así como estimular la inmunidad humoral circulante basada en IgG, la cual será primordial en la protección del oviducto.
CEPA VACUNAL A ELEGIR
Siempre es preferible una cepa vacunal que cumpla una serie de características:
VÍA DE APLICACIÓN
Aunque la mayoría de las vacunas vivas están registradas para su aplicación vía agua de bebida, oculo-nasal y por spray de gota gruesa, al igual que en todas las enfermedades respiratorias cuando existe alto nivel de desafío, es muy beneficioso una aplicación local en el tejido diana del virus.
La aplicación gota al ojo es un método en desuso debido al alto costo de mano de obra, sin embargo si la técnica de vacunación es la correcta se trata de una inmunización local óptima e individualizada, minimizamos la posibilidad de entrada de virus salvajes en nuestras explotaciones.
El spray con gota gruesa o coarse spray está aumentando su uso, especialmente a nivel de ponedoras (alojadas en jaulas) así como en pollos de engorde, donde se utiliza en incubadora con cabinas de vacunación, o pistolas de vacunación en spray, o a la llegada a la granja con mochilas de aspersión. Estos métodos necesitan ser realizados correctamente, siendo esencial el tamaño de la gota utilizado (150-180 µm), así como las condiciones sanitarias del lote. Se trata del método de aplicación que por practicidad y eficacia mejor se ajusta al modelo productivo avícola actual, generando la mejor protección respiratoria local con el menor coste.
MOMENTO DE LA APLICACIÓN
Todas las aves son susceptible a la infección con metapneumovirus (aMPV) desde el momento de nacimiento, y la inmunidad maternal no es protectiva, si bien a nivel de campo se observan cuadros clínicos más graves en lotes de pollitos procedentes de reproductoras no vacunadas.
En pollos de engorde, debido a su corta vida productiva la vacunación debe ser realizada entre los 0 y los 14 días, este hecho suponía un problema en calendarios de vacunación que incluían vacunaciones frente a Bronquitis infecciosa y Newcastle, sin embargo, recientes estudios han demostrado a nivel laboratorial que la utilización conjunta de vacuna viva atenuada subtipo B origen pollo, cepa 1062 + vacuna viva atenuada CL/79/H120 aplicada gota al ojo a 0 días, fue protectiva ante un desafío de ND, IB y aMPV 21 días después de la vacunación, estando en concordancia con estudios similares realizados por otros autores (Tarpey et al. 2006).
ESTUDIO DE CAMPO
Estos hallazgos a nivel experimental están siendo confirmados con estudios a nivel de campo mostrando mejorías significativas en lotes de pollos de engorde afectados por metapneumovirus aviar, cuando se realizaba una vacunación el mismo día con vacunas frente a Bronquitis infecciosa (cepa H120) y un virus vivo atenuado subtipo B cepa 1062 contra aMPV a 0 días en spray. Este estudio se realizó en la misma explotación durante 4 ciclos consecutivos, dos previos a la vacunación y dos con la vacunación implantada.
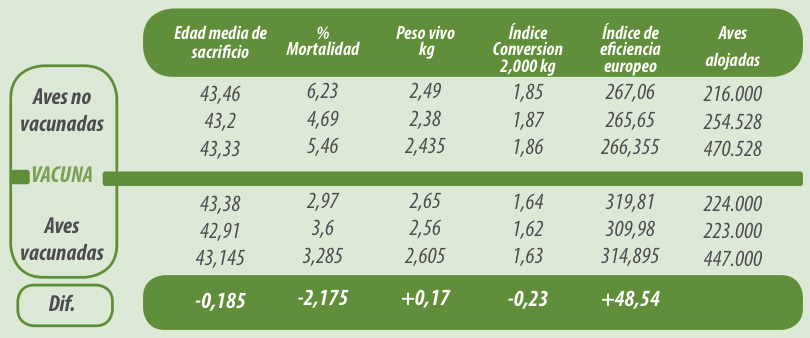
Tabla 1. Resultado de pruebas de campo de un lote de vacunados con una dosis de vacuna viva atenuada subtipo B, origen pollo, cepa 1062.
La vacunación en lotes de pollos de engorde puede ser estacional dependiendo de factores que varían a lo largo del año (deficiencias en manejo, periodos de vacío sanitario más cortos, situaciones de inmunodepresión…etc), pueden aparecer más brotes en determinadas épocas del año y de mayor gravedad en su presentación.
En ponedoras y reproductoras, puede que el factor clave venga marcado por el correcto método de vacunación, así como la programación de la vacunación.
Siempre se debe intentar vacunar con las vacunas vivas atenuadas lotes de gallinas seronegativas en un análisis ELISA,
Si no es posible, es preferible que el título sea bajo, las vacunas vivas proveen entre 10 y 15 semanas de protección si bien depende esencialmente de la presión vírica.
La primo-vacunación con las vacunas vivas debe ser entre las 0 y las 6 semanas, siempre teniendo en cuenta la dinámica infectiva del virus de campo, es muy beneficioso establecer la primo-vacunación antes de que el lotes de aves haya sufrido contacto con virus de campo. La segunda dosis de vacuna viva debería aplicarse entre las 6 y las 12 semanas de edad, en función de la edad de primo-vacunación y de la edad de vacunación con la vacuna inactivada.
En las aves en las que necesitamos una protección a largo plazo a nivel local (reproductores y ponedoras), así como un incremento del nivel de anticuerpos circulantes (IgG) con el fin de evitar la replicación del virus a nivel del epitelio del oviducto, necesitamos utilizar las vacunas inactivadas. La vacuna inactivada debe ser aplicada como tarde 2-3 semanas antes de la entrada en puesta, y con un mínimo de separación de 2-3 semanas desde la aplicación de la última vacuna viva.
El control del aMPV debe conseguirse mediante la vacunación, la bioseguridad y proporcionando a los animales el máximo confort.
Dado que etiológicamente se trata de una enfermedad vírica, los tratamientos antibioterápicos solo sirven a la hora de limitar los efectos de las infecciones bacterianas secundarias, de tal manera que el control del aMPV debe conseguirse mediante la vacunación, bioseguridad y proporcionando a los animales el máximo confort. Los tratamientos con antibióticos suelen mostrarse efectivos durante la aplicación, pero los procesos bacterianos rápidamente resurgen una vez se retira el tratamiento.
El monitoreo de los lotes sospechosos de padecer problemas asociados a aMPV es necesario para fijar un plan vacunal en el que poder incluir la vacunación frente a metapneumovirus de una forma eficaz.