Conteúdo disponível em:
Español (Espanhol)
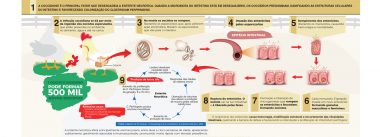
A enterite necrótica é uma doença amplamente difundida e economicamente significativa, ocasionada pela proliferação da bactéria Clostridium perfringens, associada e desencadeada por protozoários do gênero Eimeria, que preliminarmente causam a coccidiose (Figura 1). Esta doença é disseminada em todo o mundo e o mercado de produção animal gasta milhões de dólares por ano para controlá-la. Modernas ferramentas relacionadas à biologia molecular e imunologia têm sido utilizadas para ampliar o conhecimento sobre esses patógenos e suas consequências, na tentativa de desenvolver meios cada vez mais eficientes para controlar a coccidiose e como consequência a enterite necrótica.
Figura 1. Ciclo da coccidiose e enterite necrótica

Os danos causados pela coccidiose e enterite necrótica ao organismo são conhecidos, e pesquisas recentes mostram que diversas alterações intermediárias ao metabolismo de aminoácidos e energia também ocorrem, o que reforça a importância no controle da doença.
A microbiota intestinal dos animais além de modular vários processos fisiológicos, incluindo uma resposta imune protetora, nutrição, metabolismo, e exclusão de patógenos, pode alterar a fisiopatologia de doenças parasitárias conferindo resistência ou promover infecções parasitárias entéricas. As bactérias naturais do intestino atuam como adjuvantes moleculares que fornecem imunoestimulação indireta ajudando o organismo a se defender das infecções parasitárias.
Um estudo recente realizado por Huang et. al (2018), reportou que a infecção por Eimeira aumentou significativamente a quantidade de bactérias patogênicas e reduziu Lactobacillus e Ruminococcus, que são consideradas benéficas para o organismo.
Considerando que frangos de corte possuem um rápido ciclo de criação, a atenção para o risco de infecções deve ser multiplicada e a prática de medidas preventivas se torna uma ferramenta indispensável, uma vez que a coccidiose pode ocorrer a qualquer momento e, caso não controlada adequadamente, resultar em grandes prejuízos na produção.
No mercado atual existem métodos de prevenção como as vacinas (atenuadas e virulentas) e os anticoccidianos na ração, que possuem atividade antibacteriana (sintéticos e ionóforos glicosídeos) ou não bacteriana (ionóforos mono e divalentes). No entanto, o uso destes anticoccidianos ionóforos na produção animal têm sido questionada e sua restrição já é realidade em alguns mercados. Desta forma, é indispensável um plano rigoroso de manejo, sanidade e nutrição, associado à compostos alternativos suplementados às dietas que visem à melhora da integridade intestinal e modulação de respostas do sistema imune, o que fará com que os animais respondam melhor à proliferação da Eimeira.
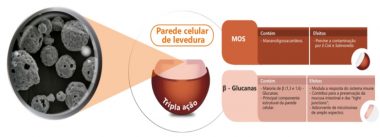
O ImmunoWall® é uma das soluções que pode ajudar no programa de controle de patógenos, uma vez que é uma solução natural que ajuda na redução da contaminação e prevenção do problema. Fundamentado neste conceito, o ImmunoWall® se sobressai aos demais produtos por ser um composto de densa parede celular de Saccharomyces cerevisiae com altas concentrações de β-Glucanas e MOS, resultando em um aditivo com garantia de resultados e ótimo custo/benefício (Figura 2).
O MOS é capaz de aglutinar bactérias patogênicas como E. coli e Salmonella, impedindo a colonização e proliferação destas populações no intestino. As β-Glucanas agem estimulando a produção e a atividade dos macrófagos, que são células de defesa de importante papel no sistema imunológico, capazes de fagocitar e destruir os microrganismos. Assim, a suplementação de ImmunoWall® assegura que as aves mantenham o equilíbrio da microbiota intestinal e melhorem as respostas do sistema imune, resultando na diminuição da contaminação e da translocação das bactérias patogênicas à outros órgãos do corpo.
Figura 2. Modos de ação do ImmunoWall®
Um estudo (dados não publicados) realizado no Southern Poultry Research (Athens, GA, EUA) pelo Prof. Dr. Charles Hofacre em 2013, foi conduzido com pintinhos de 1 dia de idade (início tratamentos dietéticos) que foram contaminados aos 14 dias com 5.000 oocistos de Eimeria maxima e aos 19, 20 e 21 dias de idade com 1×108 UFC de Clostridium perfringens por ave. Nenhum coccidiostático foi utilizado na ração e não foi administrada vacina contra coccidiose. Os resultados mostraram a eficácia na redução do escore de lesão intestinal e mortalidade nos grupos suplementados com ImmunoWall® (0,5 kg/ton até 28 dias do experimento). O grupo com as aves desafiadas e não tratadas com nenhum aditivo ou AGP, tiveram uma mortalidade de 44% e um escore de lesão de 0,575. As aves tratadas com Virginamicina (20 g/ton) tiveram uma redução de 68% em mortalidade e 35% no escore de lesão em relação ao grupo controle; já o grupo suplementado com ImmunoWall®, apresentou uma redução de 75% em mortalidade e 15% em escore de lesão (Tabela 1).
Tabela 1. Escore de enterite necrótica e mortalidade de frangos desafiados com Eimeria máxima e Clostridium perfringens.
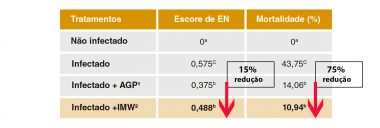
Resultados de escore de enterite necrótica (NE) aos 21 dias (a pontuação foi baseada em um escore de 0 a 3, com 0 sendo normal e 3 sendo o mais grave). A mortalidade foi verificada aos 28 dias de idade. 1AGP: Aves infectadas, 20 g/t de Virginiamicina. 2IMW: Aves infectadas, 0,5 kg/t de ImmunoWall®. Exceto para o Tratamento 1, todas as aves foram desafiadas com ~5.000 oocistos de Eimeria maxima aos 14 dias e com 1×108 UFC por ave de Clostridium perfringens aos 19, 20 e 21 dias. Pesquisa conduzida na Southern Poultry Research, Athens, GA, EUA
Outro estudo recentemente realizado por Beirão et al. (2018), analisou o efeito do ImmunoWall® sobre a integridade intestinal de frangos de corte. Aos dois dias de idade as aves foram submetidas a um desafio com Salmonella Enteritidis via oral na dosagem de 108 UFC por ave e foram alimentadas com dietas suplementadas com ImmunoWall® (0,5 kg/ton). Os resultados mostraram que aos quatro dias (dois dias pós-infecção) ImmunoWall® reduziu a passagem do marcador para o sangue no grupo desafiado, indicando que o produto melhorou a integridade intestinal.
Gráfico 2. Permeabilidade intestinal de frangos desafiados com Salmonella Enteritidis aos 4 dias de idade.
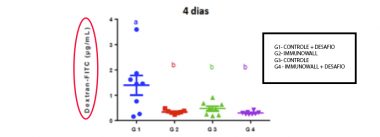
Tratamentos: Controle+SE: Controle, com desafio; IMW: Sem desafio, tratados com 0,5 kg/ton ImmunoWall®; Controle: Controle, sem desafio; IMW+SE: com desafio, tratados com 0,5 kg/ton ImmunoWall®. Avaliação da integridade (permeabilidade) intestinal. Valores mais altos indicam maior permeabilidade, o que é indicativo de menor integridade da mucosa. Relevância estatística está indicada por letras diferentes sobre cada grupo. Diferenças indicadas foram calculadas por análise de variância de uma via (one-way ANOVA) com teste de comparações múltiplas de Tukey (P < 0,05).
A microbiota intestinal é importante para a homeostase intestinal e as respostas do hospedeiro aos patógenos entéricos, e a compreensão de como as bactérias respondem à infecção deve ampliar nossa visão das doenças infecciosas. A análise do microbioma foi realizada em um estudo e os resultados mostraram que a suplementação com ImmunoWall® alterou a população da microbiota. Aos 14 e 21 dias de idade dos frangos foram encontrados gêneros marcantes, dentre eles o Ruminococccus torques e Lactobacillus. O Ruminococccus torques possui função mucolítica e está correlacionado com melhor produtividade em frangos (TOROK et al., 2011). O Lactobacillus possui dentre suas funções a produção de ácidos graxos de cadeia curta e bacteriocinas que impedem o crescimento de patógenos. Como citado anteriormente, a infecção por Eimeria reduz a quantidade de ambos os gêneros, o que reforça o uso de ImmunoWall® como uma solução preventiva e benéfica no controle da coccidiose.
Assim sendo, quanto mais eficiente um plano de controle para coccidiose, melhor a qualidade entérica, equilíbrio da microbiota e resposta imune. ImmunoWall®, além de ser um aditivo natural, é uma solução viável para melhorar a saúde intestinal e a segurança alimentar em baixas dosagens, resultando em um excelente custo/benefício.
Referências
BEIRÃO B. C. B., BONATO M. A., BORGES L. L., BARBALHO R. L. C. Yeast cell wall immunomodulatory and intestinal integrity effects on broilers challenged with Salmonella Enteritidis. In: 2018 PSA Annual Meeting. San Antonio-Texas, USA. Proceedings…. 2018.
BRESTOFF J.R., ARTIS D. Commensal bacteria at the interface of host metabolism and the immune system. Nat Immunol 14:676–684. 2013.
CHARRON A.J., SIBLEY L.D. Host cells: mobilizable lipid resources for the intracellular parasite Toxoplasma gondii. J Cell Sci. 2002.
DOMÍNGUEZ, I. Fisiopatología de la coccidiosis y la enteritis bacteriana, 2015.
Huang G., et al. Influence of Eimeria falciformis infection on gut microbiota and metabolic pathways in mice. Infect Immun 86:e00073-18. 2018.
HARP J.A., CHEN W.X., HARMSEN A.G. Resistance of severe combined immunodeficient mice to infection with Cryptosporidium parvum: the importance of intestinal microflora. Infect Immun 60:3509–3512. 1992.
HOFACRE C., B.S. LUMPKINS;, G.F. MATHIS; LOHRMANN. Efeito do ImmunoWall® e Hilyses sobre o desempenho e lesões do trato gastrointestinal de aves infectadas por Eimeria spp. e Clostridium perfringens. Dados não publicados.
KNAUS U.G., HERTZBERGER R., PIRCALABIORU G.G., YOUSEFI S.P., BRANCO DOS SANTOS F. Pathogen control at the intestinal mucosa: H2O2 to the rescue. Gut Microbes 8:67–74. 2017.
LILLEHOJ H. S., LILLEHOJ E. P. Avian coccidiosis. A review of acquired intestinal immunity and vaccination strategies. Avian Dis. 44: 408-425. 2000.
TOROK, V.A., et al. Identification and Characterization of Potential Performance-Related Gut Microbiotas in Broiler Chickens across Various Feeding Trials. Appl. Environ. Microbiol. 77, 5868–5878. 2011.
ZHOU C.X., et al. Metabolomic profiling of mice serum during toxoplasmosis progression using liquid chromatography-mass spectrometry. Sci Rep 6:19557. 2016.
Saiba mais acessando:
Assine agora a melhor revista técnica sobre avicultura
AUTORES

Indicadores-chave de desempenho da produção de frango na América Latina: Benchmarking Internacional
José Guilherme Morschel Barbosa
Desbloqueando o potencial da proteína: gerenciando inibidores de tripsina na produção de frangos no Brasil
David Torres
Pontos-chaves no manejo de reprodutores(as) para a qualidade da progênie
Jeffersson Lecznieski
Opinião do especialista – Escassez de ovos: um problema global que reforça a importância da inovação no controle de bactérias
Pablo Cifuentes
Estratégias nutricionais para redução do estresse térmico em codornas japonesas
Lucas Rocha Valfré
Inflamação intestinal: como promover uma microbiota eficiente no frango de corte?
Ricardo Hummes Rauber
Sanidade, risco e segurança alimentar: o que a Influenza Aviária ensina ao setor produtivo

Alimentação inteligente para aves livres: o que considerar?
Betina Raquel Cunha dos Santos Paula Gabriela da Silva Pires Priscila de O. Moraes
Uso de Bromexina no controle e prevenção de doenças respiratórias em frangos de corte
Fabrizio Matté Luiz Eduardo Takano Patrick Iury Roieski Victor Dellevedore Cruz
O papel da nutrição na qualidade de penas em frangos de corte
Brunna Garcia
Microminerais orgânicos: Maior biodisponibilidade para uma melhor produção animal
Equipe Técnica Biochem
A longevidade das poedeiras começa na criação
Xabier Arbe
Eleve o desempenho do incubatório com o novo serviço de suporte para incubação baseado em dados da PETERSIME
Equipe Técnica Petersime
Otimização do desempenho em situações estressantes
Felipe Horta
Vacina Corvac-4: O avanço da MSD Saúde Animal na proteção das aves contra a Coriza Infecciosa
Equipe Técnica MSD
Cobb-Vantress Brasil celebra 30 anos como hub de produção para América do Sul

Como 22 anos de genômica estão moldando o futuro da avicultura
Grant Mason