07 jan 2019
Parede celular de levedura e a resposta do sistema imune inato
Conteúdo disponível em: Español (Espanhol) Os sistemas de produção avícola são altamente desafiadores, pois além de fatores ambientas como temperatura, […]
Conteúdo disponível em:
Español (Espanhol)



macrófagos, heterófilos (equivalentes aos neutrófilos nos mamíferos), células dendríticas, células natural killer (Sharma, 2003).
Receptores do tipo Toll, localizados na superfície destas células imunológicas, reconhecem padrões microbianos e induzem uma resposta imune inata imediata. Após esta ativação e fagocitose, o fagócito (célula apresentadora de antígeno “APC”) apresenta um fragmento processado do antígeno e inicia-se uma resposta em cadeia contra este.
O reconhecimento de patógenos pelo sistema imune inato desencadeia defesas inatas imediatas e, posteriormente, a ativação da resposta imune adaptativa (Lee & Iwasaki, 2007).
É importante ressaltar que esta série de respostas do sistema imune inato demandam diversos nutrientes e principalmente, energia do metabolismo, já que se trata de uma resposta inespecífica e pró-inflamatória, porém necessária para controlar a proliferação, invasão e danos causados pelo antígeno no organismo animal.
No entanto, uma resposta pró-inflamatória prolongada, pode levar ao aparecimento de:
imunossupressão
manutenção da homeostase imunológica
disbiose intestinal
quedas em desempenho e mortalidade
A microbiota intestinal dos animais tem um papel importante na regulação da resposta do sistema imune, pois, além de modular vários processos fisiológicos, nutrição, metabolismo e exclusão de patógenos, pode alterar a fisiopatologia de doenças conferindo resistência ou promover infecções parasitárias entéricas.
As bactérias naturais do intestino atuam como adjuvantes moleculares que fornecem imunoestimulação indireta ajudando o organismo a se defender contra infecções
Desta maneira, um correto programa de vacinação, nutrição balanceada, diminuição dos fatores de estresse, boas práticas de manejo e bem-estar animal podem diminuir 
A parede celular de levedura Saccharomyces cerevisiae (ImmunoWall®, ICC Brazil) oriunda do processo de fermentação da cana-de-açúcar para produção de etanol,contém em torno de 55% de carboidratos indigestíveis totais, sendo 35% de β-glucanas (1,3 e 1,6), e 20% de 
As β-glucanas são reconhecidas pelas células fagocíticas (Petravić-Tominac et al., 2010), que desencadeiam uma resposta inata que pode ajudar o animal a modular seu sistema imunológico. Já o MOS, possui uma capacidade de aglutinação de patógenos que possuem fímbria tipo 1, tais como diversas cepas de Salmonella e Escherichia coli.

Estes resultados indicam uma melhora significativa na integridade e permeabilidade intestinal, já que a SE é uma bactéria capaz de aderir à mucosa por meio de suas fímbrias, produzir toxinas e causar danos às tight juctions (junções de oclusão) e aos enterócitos, invadindo-os e translocando-se para a corrente sanguínea e demais órgãos e tecidos internos (Figura 1).
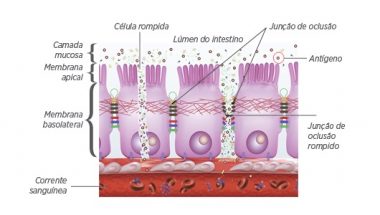
Figura 1. Dinâmica do processo de dano às tight junctions pelos antígenos.
Estes resultados podem ser explicados pela quantificação de células circulantes que foram analisadas no sangue coletado destas aves.
É importante notar que durante a dinâmica normal de uma infecção, ocorre uma mobilização dos leucócitos do sangue para o intestino, porém se animal apresentar outro tipo de infecção, a redução de leucócitos totais circulantes, pode prejudicar a resposta ao ataque à este segundo antígeno/local. Isto principalmente pode ser perigoso quando a taxa de leucócitos totais no sangue está muito baixa (leucopenia).
Na análise do referido estudo
proporcionou uma menor mobilização dos leucócitos do sangue para o intestino aos 14 dias; no entanto, quando esse sistema imune é subdividido e as diferentes células são analisadas, os animais deste grupo apresentaram mais APC’s, monócitos supressores (impedem uma resposta imune desenfreada), e linfócitos T auxiliares (CD4 – secretam interleucinas e estimulam a multiplicação de células que irão atacar o antígeno), que o grupo de animais desafiados e não tratados.
Apresentou respostas intermediárias (entre o controle desafiado e o não desafiado) às células analisadas citadas acima, e também Linfócitos T citotóxicos (CD8), que são importantes para prevenir ou controlar a invasão da Salmonella, já que estas tem a capacidade de invadir monócitos e assim translocar-se para o fígado e demais órgãos.
No gráfico 1 abaixo, é possível observar que suplementação com ImmunoWall® resultou na maior produção IgA anti Salmonella aos 14 dias de idade. Isto mostra que a resposta específica do sistema imunológico foi mais rápida e mais forte, consumindo menos energia e nutrientes, já que a resposta inflamatória pareceu ser mais curta.
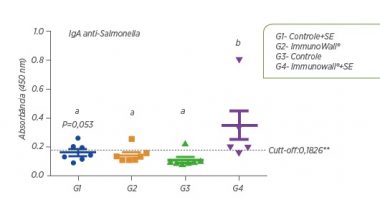
Gráfico 1. Quantificação relativa de IgA no soro reagente contra LPS da bactéria. A linha de corte (cut-off) está representada. Relevância estatística está indicada por letras diferentes sobre cada grupo. Teste de ANOVA com pós-teste de Tukey (P<0,05, exceto quando indicado em contrário).

Assim, a suplementação de β-glucanas pode ajudar a ave a ter uma ativação e resposta do sistema imune inato precoce e mais rápida, reduzindo/minimizando os danos causados pelo patógeno e consequentemente, as perdas em desempenho.

Diversos outros estudos provaram a eficácia de ImmunoWall® em reduzir a contaminação de patógenos nas aves e ovos (Hofacre et al., 2017; Ferreira et al., 2014), mortalidade e melhorar o desempenho produtivo (Bonato et al., 2016; Rivera et al., 2018; Koiyama, et al. 2018), principalmente sob desafio.
Não existem aditivos alimentares que possam suprir problemas com manejo, plano sanitário, vacinação, nutrição, qualidade de água, entre outros; os aditivos são ferramentas que podem ajudar no controle e prevenção. Sabemos que a produção animal intensiva é um ambiente altamente desafiador, assim o fortalecimento do sistema imunológico pode ser uma das chaves para maior produtividade.
Referências:
Beirão B. C. B. et al. Yeast cell wall immunomodulatory and intestinal integrity effects on broilers challenged with Salmonella Enteritidis. In: 2018 PSA Annual Meeting. San Antonio-Texas, USA. Proceedings…. 2018.
Bonato et al. Desempenho de frangos de corte alimentados com mananoligossacarídeos, parede celular de levedura e nucleotídeos de diferentes fontes. In: Conferência FACTA 2016 de Ciência e Tecnologia Avícolas, Atibaia. Proceedings….2016.
Dalloul, R. A., H. S. Lillihoj. Poultry coccidiosis: recent developments in control measures and vaccine development. Expert Rev. Vaccines, v. 5, p.143-163, 2006.
Ferreira, A.J.P. et al. Uso da associação de levedura e fonte de nucleotídeos na redução da colonização entérica por Salmonella Hiedelberg em frangos. In: Conferência FACTA 2014 de Ciência e Tecnologia Avícolas, Atibaia. Proceedings…. 2014.
Hofacre, C., et al. Use of a yeast cell wall product in commercial layer feed to reduce S.E. colonization. Proceedings of 66th Western Poultry Disease Conference, March 2017, Sacramento, CA, p. 76-78, 2017.
Koiyama, et al. Effect of yeast cell wall supplementation in laying hen feed on economic viability, egg production, and egg quality. The Journal of Applied Poultry Research, v. 27 (1), p. 116–123, 2018.
Lee, H. K., A. Iwasaki. Innate control of adaptive immunity: dendritic cells and beyond. Semin. Immunol., n. 19, p.48-55, 2007.
Petravić-Tominac, V. et al. Biological effects of yeast β-glucans. Agriculturae Conspectus Scientificus, n. 75, v. 4, 2010.
Rivera et al. Yeast cell wall and hydrolyzed yeast as a source of nucleotides effects on immunity, gut integrity and performance of broilers. In: 2018 International Poultry Scientific Forum. Atlanta-GA, USA. Proceedings…. p. 49, 2018.
Rocha, T.M., Andrade, M.A., Santana, E.S., Fayad, A.R., Matias, T.D. Aspectos clínicos, patológicos e epidemiológicos de doenças imunossupressoras em aves. Enciclopédia Biosfera, Centro Científico Conhecer, v.10, n.18, p. 25, 2014.
Sharma, J. M. The avian immune system. In: Saif, Y. M. (ed.), Diseases of Poultry, 11th ed., pp. 5-16. Iowa State Press, Ames, IA, 2003.