


A avicultura é um setor vital para produção nacional e mundial de alimentos. Além da geração de empregos em massa, fornece alimento para o Brasil e o mundo.

A tendência de aumento na produção segue a demanda do consumidor, que finalizou o ano de 2019 com consumo per capita de 230 ovos, 8,4% maior em relação ao 2018 (ABPA, 2020).
Para atender a demanda do mercado consumidor é necessário produzir mais e com qualidade. E para que isto ocorra precisamos que a ave de postura esteja bem estruturada, com uniformidade, recebendo uma dieta balanceada, com capacidade de ingestão e transformação desse alimento, o que ocorre em um trato digestivo relativamente curto e com trânsito rápido, podendo resultar em digestão e absorção incompleta dos nutrientes (Fathi et al., 2018).




Probióticos: muito além da qualidade intestinal
Neste contexto, fundamentalmente, a ave precisa de:




Os fatores que influenciam diretamente na saúde intestinal, também infuenciam no bem-estar da ave (Bostvironnois and Lundberg, 2018).





(Kotzampassi and Giamarellos-Bourboulis, 2012; Hill et al., 2014; Zoumpopoulou et al., 2018; Judkins et al., 2020).
Probióticos: muito além da qualidade intestinal
A figura 1 ilustra o modo de ação dos bacilos na microbiota.
A dinâmica que precisa ser compreendida é que a saúde intestinal consiste no equilíbrio da microbiota, entre as bactérias potencialmente benéficas e as bactérias potencialmente patogênicas.

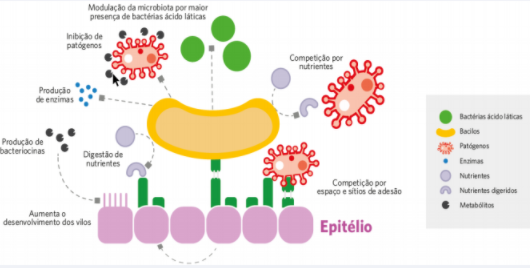
Figura 1: Modo de ação dos bacilos no trato gastrointestinal da ave.
Outro benefício atribuído ao uso de probióticos é a produção de serotonina.
De acordo com a (Almeida, 2020) 90% da serotonina, o hormônio da felicidade, é produzida no intestino, logo a relação direta com a microbiota. A figura 2 descreve o ciclo do bem-estar e os benefícios associados à integridade intestinal.
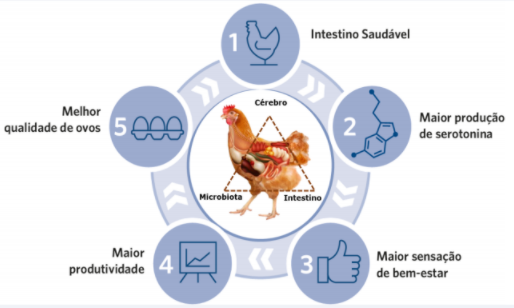
Figura 2: Ciclo do bem estar animal e os benefícios associados à integridade intestinal.






Além de melhora nos indicadores de produtividade como:


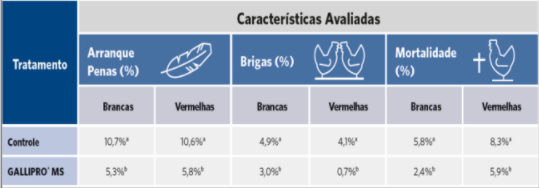
Tabela 1: Indicadores de bem estar avaliados.
Médias seguidas por letras diferentes na coluna diferem entre si pelo teste de Tukey (p<0,05). Controle = aves brancas, alimentadas com dietas sem probiótico e com antibiótico; Tratamento = aves brancas, alimentadas com 400g/t de probiótico GALLIPRO® MS e sem antibiótico. CV (%) = Coeficiente de variação.
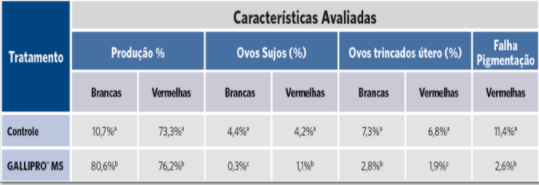
Tabela 2: Índices produtivos avaliados.
Médias seguidas por letras diferentes na coluna diferem entre si pelo teste de Tukey (p<0,05). Controle = aves brancas, alimentadas com dietas sem probiótico e com antibiótico; Tratamento = aves brancas, alimentadas com 400g/t de probiótico GALLIPRO® MS e sem antibiótico. CV (%) = Coeficiente de variação.

Promover a colonização precoce do trato gastrintestinal e a manutenção com bactérias probióticas estabelecerá uma microbiota saudável e aumentará a resistência à colonização por bactérias patogênicas, (Zoumpopoulou et al., 2018; Judkins et al., 2020; Kogut et al., 2020).



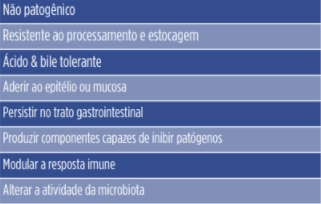
Tabela 3: Características ideais dos probiótico.
Adaptado de (Patterson and Burkholder, 2003; Pandey et al., 2015).
SELECIONANDO UM PROBIÓTICO
Atualmente, existe uma grande variedade de probióticos disponíveis no mercado. Para o maior sucesso na escolha, prefira fornecedores certificados com cepas documentadas.
Além disso, é importante ressaltar que as cepas possuem características distintas e conhecê-las é importante para a melhor efetividade. Apenas como exemplo:
A espécie Bacillus subtilis possui mais de 1000 cepas sequenciadas com diferenças genéticas de aproximadamente 20%, além de características morfológicas, bioquímicas e comportamentais distintas.
Com isso, compreendemos a necessidade de critério no momento de selecionar um probiótico (Koedijk and Bostvironnois, 2017).
A segurança em relação ao uso das cepas probióticas também é um ponto a ser observado. Cada cepa é cuidadosamente selecionada, seguindo diferentes critérios para cada espécie animal (Zoumpopoulou et al., 2018) e resultados obtidos em estudos de eficácia in vivo e in vitro.




Os bacilos são manipulados na forma de esporos, consequentemente muito resistentes a extremos de pH e temperatura (Nicholson, 2002; Jeong and Kim, 2014). Não apenas resistentes, como também capazes de colonizar o trato gastrointestinal de forma transitória, com poder de germinação e interação com a microbiota para produzir efeitos benéficos (Cartman et al., 2008; Latorre et al., 2014).
A figura 3 relaciona a viabilidade do Bacillus subtilis submetido diferentes temperaturas de peletização.
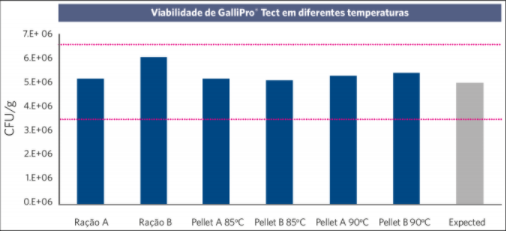
Figura 3: Viabilidade do Bacillus licheniformis antes e após a peletização.


A mensuração de bacilos é outro ponto importante e deve ser checado a partir da Prova de Recuperação de Bacilos (PRB).

Esta prova permite:


O plano amostral deve incluir amostras de ração colhidas no silo e comedouro e amostras de cama e fezes, conforme figura 4.
Figura 4: Presença de bacilos viáveis em diferentes momentos.


ABPA: Associação Brasileira de Proteína Animal. (Acesso em 15 de agosto de 2020) Disponível em < https://abpa-br.org/abpa-lanca-relatorio-anual-2020/
Agazzi, A. 2015. The Beneficial Role of Probiotics in Monogastric Animal Nutrition and Health. J. Dairy, Vet. Anim. Res. 2:116–132.
Almeida, I. C. L. 2020. Bem-Estar & Produtividade.Boletim Técnico. Ed.1, 2020.
Bostvironnois, C., and R. Lundberg. 2018. Microbiome stability: the challenge of modern broiler production. Available at https://www.dairyglobal.net/Health/ Articles/2018/12/Microbiome-stability-in-modern-broilers-372964E/.
Cartman, S. T., R. M. La Ragione, and M. J. Woodward. 2008. Bacillus subtilis spores germinate in the chicken gastrointestinal tract. Appl. Environ. Microbiol. 74:5254–5258.
Fathi, M., I. Al-homidan, A. Al-dokhail, T. Ebeid, O. Abou-emera, and A. Alsagan. 2018. Effects of dietary probiotic ( Bacillus subtilis ) supplementation on productive performance , immune response and egg quality characteristics in laying hens under high ambient temperature. Ital. J. Anim. Sci. 0:804–814 Available at https://doi.org/10.1080/1828051X.2018.1425104.
Hill, C., F. Guarner, G. Reid, G. R. Gibson, D. J. Merenstein, B. Pot, L. Morelli, R. B. Canani, H. J. Flint, S. Salminen, P. C. Calder, and M. E. Sanders. 2014. Expert consensus document: The international scientific association for probiotics and prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat. Rev.Gastroenterol. Hepatol. 11:506–514.
Instituto Brasileiro de Geográfia e Estatística (Acesso em 15 agosto de 2020): Disponível em: https://www.ibge.gov.br/estatisticas/economicas/agricultura-e-pecuaria/9216-pesquisa-trimestral-da-producao-de-ovos-de-galinha.html?edicao=27826&t=downloads
Jeong, J. S., and I. H. Kim. 2014. Effect of Bacillus subtilis C-3102 spores as a probiotic feed supplement on growth performance, noxious gas emission, and intestinal microflora in broilers. Poult. Sci. 93:3097–3103 Available at http://dx.doi.org/10.3382/ps.2014-04086.
Judkins, T. C., D. L. Archer, D. C. Kramer, and R. J. Solch. 2020. Probiotics, Nutrition, and the Small Intestine. Curr. Gastroenterol. Rep. 22:2 Available at http://link.springer. com/10.1007/s11894-019-0740-3.
Koedijk, R., and C. Bostvironnois. 2017. Strains matter : selected combinations is the key to a successful solution. Int. Poult. Prod. 27:11–12.
Kogut, M. H., A. Lee, and E. Santin. 2020. Microbiome and pathogen interaction with the immune system. Poult. Sci. 99:1906–1913 Available at https://doi.org/10.1016/j. psj.2019.12.011.
Kotzampassi, K., and E. J. Giamarellos-Bourboulis. 2012. Probiotics for infectious diseases: More drugs, less dietary supplementation. Int. J. Antimicrob. Agents 40:288–296.
Latorre, J. D., X. Hernandez-Velasco, G. Kallapura, A. Menconi, N. R. Pumford, M.J. Morgan, S. L. Layton, L. R. Bielke, B. M. Hargis, and G. Téllez. 2014. Evaluation of germination, distribution, and persistence of Bacillus subtilis spores through the gastrointestinal tract of chickens. Poult. Sci. 93:1793–1800.
Nicholson, W. L. 2002. Roles of Bacillus endospores in the environment. Cell. Mol. Life Sci. 59:410–416.
Pandey, K. R., S. R. Naik, and B. V. Vakil. 2015. Probiotics, prebiotics and synbiotics- a review. J. Food Sci. Technol. 52:7577–7587.
Patterson, J. A., and K. M. Burkholder. 2003. Application of prebiotics and probiotics in poultry production. Poult. Sci. 82:627–631 Available at http://dx.doi.org/10.1093/ ps/82.4.627.
Pickard, J. M., M. Y. Zeng, R. Caruso, and G. Núñez. 2017. Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease. Immunol. Rev. 279:70–89.
Thursby, E., and N. Juge. 2017. Introduction to the human gut microbiota. Biochem. J.474:1823–1836.
Upadhaya, S. D., F. Rudeaux, and I. H. Kim. 2019. Efficacy of dietary Bacillus subtilis and Bacillus licheniformis supplementation continuously in pullet and lay period on egg production, excreta microflora, and egg quality of Hyline-Brown birds. Poult. Sci. 98:4722–4728 Available at http://dx.doi.org/10.3382/ps/pez184.
Zoumpopoulou, G. Kazou M. Alexandraki, V. A, Angelopoulou. Papadimitriou, K. Pot, B., Tsakalidou, E. Probiotics and Prebiotics: An Overview on Recent. In Di Gioia, D. Biavati, B. Probiotics and prebiotics in animal health and food safety. Springer, 2018, Cap. 1, p. 1-34.
Assine agora a melhor revista técnica sobre avicultura
AUTORES

Indicadores-chave de desempenho da produção de frango na América Latina: Benchmarking Internacional
José Guilherme Morschel Barbosa
Desbloqueando o potencial da proteína: gerenciando inibidores de tripsina na produção de frangos no Brasil
David Torres
Pontos-chaves no manejo de reprodutores(as) para a qualidade da progênie
Jeffersson Lecznieski
Opinião do especialista – Escassez de ovos: um problema global que reforça a importância da inovação no controle de bactérias
Pablo Cifuentes
Estratégias nutricionais para redução do estresse térmico em codornas japonesas
Lucas Rocha Valfré
Inflamação intestinal: como promover uma microbiota eficiente no frango de corte?
Ricardo Hummes Rauber
Sanidade, risco e segurança alimentar: o que a Influenza Aviária ensina ao setor produtivo

Alimentação inteligente para aves livres: o que considerar?
Betina Raquel Cunha dos Santos Paula Gabriela da Silva Pires Priscila de O. Moraes
Uso de Bromexina no controle e prevenção de doenças respiratórias em frangos de corte
Fabrizio Matté Luiz Eduardo Takano Patrick Iury Roieski Victor Dellevedore Cruz
O papel da nutrição na qualidade de penas em frangos de corte
Brunna Garcia
Microminerais orgânicos: Maior biodisponibilidade para uma melhor produção animal
Equipe Técnica Biochem
A longevidade das poedeiras começa na criação
Xabier Arbe
Eleve o desempenho do incubatório com o novo serviço de suporte para incubação baseado em dados da PETERSIME
Equipe Técnica Petersime
Otimização do desempenho em situações estressantes
Felipe Horta
Vacina Corvac-4: O avanço da MSD Saúde Animal na proteção das aves contra a Coriza Infecciosa
Equipe Técnica MSD
Cobb-Vantress Brasil celebra 30 anos como hub de produção para América do Sul

Como 22 anos de genômica estão moldando o futuro da avicultura
Grant Mason