เนื้อหาดูได้ที่: English (อังกฤษ) Indonesia (อินโดนีเซีย) Melayu (Malay) Tiếng Việt (เวียดนาม) Philipino (ฟิลิปปินส์)
- ไก่เนื้อในยุคปัจจุบันถือเป็นสัญลักษณ์ที่เด่นชัดของความก้าวหน้าทางพันธุกรรม
- การคัดเลือกพันธุ์ การให้อาหารที่มีคุณภาพ การดูแลสุขภาพ และมาตรการการจัดการที่เข้มข้น ล้วนเป็นปัจจัยที่นำไปสู่ความสำเร็จเหล่านี้
- อย่างไรก็ตาม การรักษาสภาพของทางเดินอาหาร (GIT) ให้อยู่ในสภาพที่ดีนั้น เป็นสิ่งสำคัญยิ่งต่อกระบวนการผลิตที่มีประสิทธิภาพ
- เนื่องจากการเปลี่ยนแปลงที่เกิดขึ้นในระหว่างการเจริญเติบโตของลำไส้มีความละเอียดอ่อนมาก มักถูกมองข้ามไป แต่แท้จริงแล้ว สุขภาพของลำไส้มีผลกระทบโดยตรงต่อสุขภาพโดยรวมและประสิทธิภาพการผลิตของไก่
- อย่างไรก็ตาม การรักษาสภาพของทางเดินอาหาร (GIT) ให้อยู่ในสภาพที่ดีนั้น เป็นสิ่งสำคัญยิ่งต่อกระบวนการผลิตที่มีประสิทธิภาพ
ในปัจจุบัน ระบบการผลิตสัตว์ต้องการการค้นคว้าและพัฒนาต่อเนื่อง เพื่อบรรเทาผลกระทบจากความเครียดและการอักเสบเรื้อรัง ซึ่งส่งผลต่อการใช้พลังงานในการผลิตสัตว์
แม้จะไม่มี “วิธีการเดียว” ที่สามารถแก้ไขปัญหาที่เกิดจากความเครียดเรื้อรังได้อย่างครบถ้วน แต่มีการศึกษาในหลายชิ้นที่แสดงให้เห็นถึงการปรับปรุงความสมดุลของจุลชีพในลำไส้ การเผาผลาญพลังงาน และความสมบูรณ์ของระบบทางเดินอาหาร ผ่านการใช้ผลิตภัณฑ์ทางเลือกต่างๆ เช่น
- โพรไบโอติกส์
- พรีไบโอติกส์
- กรดอินทรีย์
- สารสกัดจากพืช
- น้ำมันหอมระเหย
- แร่ธาตุเสริม
นี่เป็นแนวโน้มทางวิทยาศาสตร์ระดับสากล เนื่องจากมีผลกระทบต้านการอักเสบ ต้านอนุมูลอิสระ และการปรับปรุงการทำงานของระบบภูมิคุ้มกัน รวมถึงการปรับปรุงความสมบูรณ์ของลำไส้
การแทนที่ยาปฏิชีวนะในระบบการผลิตด้วยผลิตภัณฑ์ทางเลือก การปรับปรุงการจัดการ การปฏิบัติตามมาตรการด้านความปลอดภัยทางชีวภาพที่เข้มงวด การใช้วัตถุดิบคุณภาพ การปราศจากโรค (เช่น ไมโคพลาสมา/แซลโมเนลลา) และโปรแกรมการฉีดวัคซีนที่มีประสิทธิภาพเป็นกลยุทธ์ที่มีประสิทธิภาพในการบรรลุเป้าหมายด้านสุขภาพและการผลิต
ในงานวิจัยนี้ เรามุ่งเน้นในการทบทวนผลกระทบที่สำคัญของความเครียดเรื้อรังและการอักเสบในลำไส้ต่อสุขภาพและประสิทธิภาพของไก่เชิงพาณิชย์
โครงสร้างของทางเดินอาหารในไก่และองค์ประกอบสำคัญ
นอกจากหน้าที่ในการดูดซึมน้ำและการย่อยอาหารแล้ว ทางเดินอาหารยังเป็นที่อยู่ของชุมชนจุลินทรีย์ที่มีความหลากหลายและซับซ้อน (Celluzzi และ Masotti, 2016) อีกทั้งยังมีระบบประสาทในลำไส้ (ENS) ซึ่งมักถูกเรียกว่า “สมองที่สอง” ของสิ่งมีชีวิต (Schneider et al., 2019)
ในกรณีของไก่เนื้อ โครงสร้างที่เกี่ยวข้องกับต่อมน้ำเหลืองในลำไส้ (GALT) มีความเข้มข้นของเซลล์ภูมิคุ้มกันสูงที่สุดในสิ่งมีชีวิต ซึ่งแสดงให้เห็นถึงความสำคัญของมัน (Peralta et al., 2017; Casteleyn et al., 2010)
- นอกจากนี้ ระบบย่อยอาหารยังประกอบด้วยอวัยวะหลักที่เกี่ยวข้องกับน้ำเหลือง เช่น Bursa of Fabricius ซึ่งเป็นแหล่งกำเนิดและขยายตัวของ B lymphocytes องค์ประกอบนี้ของ GALT ในสัตว์ปีกมีบทบาทสำคัญในการปกป้องระบบย่อยอาหารจากอันตรายต่างๆ (Bar-Shira et al., 2003)
จุลชีพในลำไส้สามารถมีอิทธิพลต่อชีววิทยาของเจ้าบ้าน, โภชนาการ, ภูมิคุ้มกัน และระบบประสาทต่อมไร้ท่อ (Dimitrov, 2011).
การทำงานของทางเดินอาหารดูเหมือนว่าจะถูกควบคุมโดยกรดไขมันสายสั้น (SCFA) ที่เกิดจากการหมักของแบคทีเรีย (Wu et al., 2017), การสื่อสารระหว่างจุลชีพและเซลล์ประสาท (Megur et al., 2020), ระบบต่อมไร้ท่อ (Fukui et al., 2018), ระบบภูมิคุ้มกัน (Maslowski และ Mackay, 2011) และการปรับการทำงานของเกราะลำไส้ (Sharma et al., 2010)
- ระบบประสาทในลำไส้ (ENS) และเครือข่ายต่อมไร้ท่อในลำไส้ควบคุมการเคลื่อนไหวของทางเดินอาหารและการรบกวนในภาวะผิดปกติของทางเดินอาหาร (Fukui et al., 2018)
เซลล์เอ็นเทอโรเอนโดคริน (EECs) พบได้ทั่วทั้งผิวเซลล์ของทางเดินอาหารและผลิตฮอร์โมนหลายชนิด (Gribble และ Reimann, 2019)
ฮอร์โมนในทางเดินอาหารที่ถูกค้นพบเป็นครั้งแรก ได้แก่:
- กาสตริน
- ซีเครติน
- โคเลซีสโตไคนนิน
- อินซูลิน
- กลูคากอน
มีการค้นพบฮอร์โมนและเปปไทด์ทางชีวภาพมากกว่า 50 ชนิด ซึ่งทำให้ทางเดินอาหารกลายเป็นอวัยวะสำคัญที่แสดงกิจกรรมในรูปแบบต่าง ๆ ได้แก่ ต่อมไร้ท่อ, ต่อมไร้ท่อประสาท, ออโตไครน์ และพาราคริน (Rao และ Wang, 2010; Gribble และ Reimann, 2017)
ในสัตว์หลายเซลล์ เซลล์เอ็นเทอโรโครมาฟฟินซึ่งอยู่ในลำไส้ เป็นกลุ่มย่อยของเซลล์เอ็นเทอโรเอนโดครินที่มีความสำคัญ ผลิตเซโรโทนิน (5-ไฮดรอกซีทริปตามีน) ซึ่งทำหน้าที่เป็นสารสื่อประสาทที่มีปริมาณถึง 90% (Lund et al., 2018)
จุลชีพในลำไส้มีบทบาทสำคัญในการควบคุมการหลั่งฮอร์โมน เช่น เซโรโทนิน, โดปามีน, ออกซิโตซิน และเอนดอร์ฟิน ซึ่งผลิตโดยเซลล์เอ็นเทอโรเอนโดคริน (EECs) (Forsythe et al., 2010; Liang et al., 2014; Mayer et al., 2014) นี่แสดงให้เห็นถึงความเชื่อมโยงระหว่างจิตใจและร่างกายในคำกล่าวที่ว่า “ความรู้สึกในลำไส้”
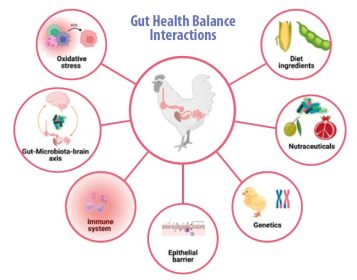
- การรักษาสมดุลในสุขภาพลำไส้ หรือที่เรียกว่าโฮมิโอสตาซิส เป็นเรื่องที่ซับซ้อน ซึ่งได้รับอิทธิพลจากปัจจัยหลายประการ เช่น แกนสมอง-ลำไส้-จุลชีพในลำไส้, ระบบภูมิคุ้มกัน, ความเครียดจากอนุมูลอิสระ, โภชนาการ, เกราะลำไส้, ปัจจัยทางพันธุกรรม และการใช้สารเสริมอาหาร เช่น นูโทรซูติคัล (ดูรูปที่ 1)
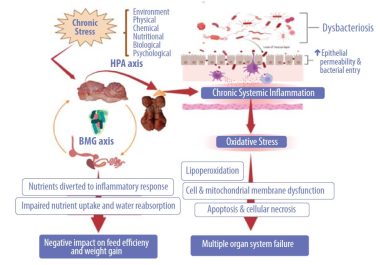
ความเครียดและการอักเสบที่เกิดขึ้นอย่างต่อเนื่องมีผลกระทบที่ไม่ดีต่อความสัมพันธ์ระหว่างสมอง ลำไส้ และจุลชีพในลำไส้ ซึ่งนำไปสู่ภาวะดิสแบคทีเรียโอซิส (dysbiosis) และทำให้โปรตีนที่ทำหน้าที่เชื่อมต่อเซลล์ (tight junction proteins) เสียหาย นอกจากนี้ยังมีการเคลื่อนย้ายของแบคทีเรียและสารแอนติเจนอื่น ๆ ไปทั่วร่างกาย (ดูรูปที่ 2)
ในช่วงเวลาที่มีความเครียดเรื้อรังและการอักเสบในลำไส้ พลังงานที่ควรใช้ในการเจริญเติบโตและการสืบพันธุ์กลับถูกเบี่ยงเบนไปเพื่อสนับสนุนการตอบสนองต่อการอักเสบ ซึ่งสิ่งนี้ก็ไม่แตกต่างไปจากกรณีของไก่เช่นกัน
แกน HPA
- แกนฮีโปทาลามิก–พิทูอิทารี–อะดรีนัล (HPA axis) เป็นเครือข่ายที่ซับซ้อนของอิทธิพลโดยตรงและปฏิกิริยาตอบกลับระหว่างสามองค์ประกอบ ได้แก่ ฮีโปทาลามัส, ต่อมพิทูอิทารี, และต่อมอะดรีนัลที่ตั้งอยู่บนไต (Lu et al., 2021)
- แกน HPA เป็นระบบประสาทต่อมไร้ท่อที่สำคัญที่ควบคุมการตอบสนองต่อความเครียด
- มันควบคุมระบบทางสรีรวิทยาหลายระบบ รวมถึงการย่อยอาหาร, ระบบภูมิคุ้มกัน, อารมณ์และความรู้สึก, เพศสัมพันธ์, และการสะสมและการใช้พลังงานในตอบสนองต่อสิ่งกระตุ้นจากสิ่งแวดล้อม (Cohen et al., 2006)
เชื้อก่อโรคและโรคต่างๆ
- โดยทั่วไปแล้ว ความเสียหายที่เกิดขึ้นอย่างต่อเนื่อง หรือการมีอยู่ของตัวแทนที่ก่อให้เกิดโรคในทางเดินอาหาร จะกระตุ้นให้เกิดกระบวนการเครียดในระบบทางเดินอาหาร ซึ่งส่งผลให้เกิดการอักเสบและความเครียดจากออกซิเดชัน (Federico et al., 2007)
- ในบรรดาเชื้อโรคที่อาจพบในทางเดินอาหาร เราสามารถกล่าวถึงแบคทีเรียและโปรโตซัว ซึ่งการติดเชื้อเหล่านี้สามารถทำให้เกิดความเสียหายอย่างรุนแรงในทางเดินอาหาร ส่งผลให้เกิดโรคและอัตราการตายที่สูง
- ในไก่ เชื้อ Eimeria tenella ถือเป็นเชื้อก่อโรคหลักที่มีผลกระทบต่อการเจริญเติบโต การใช้สารอาหาร และการผลิต โดยทำให้เกิดโรคไทฟไลติสชนิดเนื้อเยื่อและเลือด (necro-hemorrhagic typhlitis) (Soutter et al., 2021)
- นอกจากนี้ ยังมีโปรโตซัวอีกชนิดหนึ่งที่มีผลต่อกระเปาะ คือ Histomonas meleagridis ซึ่งเป็นต้นเหตุของโรคฮิสโตโมโนซิสในไก่และไก่งวง ซึ่งมักจะสามารถควบคุมได้ด้วยการใช้สารอาร์เซนิกในอาหาร
- ทางเลือกในการควบคุมการติดเชื้อโปรโตซัว
การควบคุมการติดเชื้อโปรโตซัวมีหลายวิธีที่น่าสนใจ ซึ่งรวมถึงการใช้สารเสริมอาหารและสารปรับภูมิคุ้มกัน, ตัวช่วยเสริม (adjuvants) และการพัฒนาวัคซีนรีคอมบิแนนท์ - อย่างไรก็ตาม ปัจจุบันยังไม่มีวัคซีนเชิงพาณิชย์สำหรับ H. meleagridis (Liebhart et al., 2017)
- ทำให้ความจำเป็นในการค้นหาวิธีการแก้ปัญหาที่มีประสิทธิภาพสูงขึ้นเพื่อบรรเทาผลกระทบจากโรคโคคซิเดียในไก่และโรคฮิสโตโมโนซิสเป็นเรื่องที่สำคัญยิ่ง
- ในขณะเดียวกัน ทรัพยากรที่สำคัญยังต้องการการเสริมเพิ่มเติม ส่งผลให้การพัฒนาและความก้าวหน้าในด้านนี้เป็นไปอย่างช้า ๆ
นอกจากนี้ การติดเชื้อแบคทีเรียซึ่งถือเป็นปัญหาที่เกี่ยวข้องกับทางเดินอาหาร ยังสามารถกระตุ้นกระบวนการอักเสบเฉียบพลันหรือแม้กระทั่งอักเสบเรื้อรังได้ (Yamamoto et al., 2013)
ในแบบจำลองการศึกษา พบว่าการเจริญเติบโตของเชื้อ Salmonella ได้รับอิทธิพลจากการตอบสนองทางอักเสบเฉียบพลัน ซึ่งเกิดจากการติดเชื้อแบคทีเรียในลำไส้ โดยมีการเคลื่อนที่ของนิวโทรฟิลส์และการผลิตอนุมูลอิสระออกซิเจน (ROS) รวมถึงอนุมูลไนโตรเจน (RNS) ที่ส่งผลให้สมดุลของจุลชีพในลำไส้ถูกทำลาย (Winter et al., 2010a)
เมื่อมีการเพิ่มขึ้นของออกซิเจนโมเลกุลในลำไส้ จะทำให้แบคทีเรียแอนแอโรบิกที่สำคัญ อย่างเช่น Bacteroidetes และ Clostridiales ซึ่งมีบทบาทในการผลิตกรดบิวทิริกที่จำเป็นสำหรับร่างกายถูกทำลายลง (Rigottier-Gois, 2013)n increase in molecular oxygen in the lumen of the gut depletes important commensal anaerobes like Bacteroidetes and Clostridiales, which are essential butyric acid-producing bacteria (Rigottier-Gois, 2013).
นอกจากนี้ การออกซิเดชั่นของไธโอซัลเฟตเป็นเตตราธิโอไนท์ก็เป็นผลผลิตที่เกิดจาก ROS เช่นกัน (Winter et al., 2010b) ในแบบจำลองเมาส์ยังมีการแสดงให้เห็นว่า Salmonella สามารถใช้เตตราธิโอไนท์เพื่อส่งเสริมการเจริญเติบโตของมันได้ (Winter et al., 2010b) และเตตราธิโอไนท์บรูธยังเป็นส่วนประกอบสำคัญในสื่อที่ใช้ในการเพาะเลี้ยง Salmonella ในห้องปฏิบัติการวินิจฉัยอีกด้วย

อย่างไรก็ตาม การศึกษาล่าสุดได้เผยให้เห็นข้อมูลที่แตกต่างกันในกรณีของไก่ (Saraiva et al., 2021)
- เมื่อเปรียบเทียบกับแบบจำลองในหนู โดยพบว่า ยีน ttrA และ pduA ในสัตว์ปีกไม่ได้มีบทบาทสำคัญในการกำหนดความรุนแรงของการขับถ่ายเชื้อ Salmonella Enteritidis และ Salmonella Typhimurium ผ่านอุจจาระแต่อย่างใด
- สัตว์ปีกมีลักษณะเฉพาะที่น่าสนใจ เนื่องจากพวกมันไม่มีระบบกระเพาะปัสสาวะ และกระบวนการขับของเสียจากไตจะเชื่อมต่อโดยตรงกับระบบทางเดินอาหาร
- สำหรับไก่งวงและไก่ ทั้งคู่มีส่วนที่เรียกว่า “โคลอาคา” (cloaca) ซึ่งทำหน้าที่เป็นทางเดินขับของเสียร่วมกัน (Goldstein, 2006)
- ซึ่งแตกต่างจากสัตว์เลี้ยงลูกด้วยนมที่มีการควบคุมองค์ประกอบของของเหลวในร่างกายโดยไตอย่างอิสระ ในสัตว์ปีก ปัสสาวะจะไหลเข้าสู่โคลอาคาโดยกระบวนการเคลื่อนไหวแบบ peristaltic กลับ (reverse peristalsis) ไปยังไส้ติ่ง (ceca) (Karasawa and Duke, 1995; Duke, 1999)
- ไตและระบบทางเดินอาหารส่วนล่างมีบทบาทสำคัญในการควบคุมองค์ประกอบของของเหลวภายนอกเซลล์ โดยเฉพาะอย่างยิ่งในไส้ติ่งของสัตว์ปีกที่ทำหน้าที่สำคัญในการดูดซึมน้ำ การย่อยเส้นใยผ่านกระบวนการหมักของแบคทีเรีย รวมถึงการหมุนเวียนไนโตรเจน และการสังเคราะห์วิตามินจากจุลินทรีย์ นอกจากนี้ยังมีการควบคุมสมดุลของน้ำอย่างมีประสิทธิภาพ (Duke, 1982; Duke et al., 1983; Hall and Duke, 2000)
- องค์ประกอบของอาหารที่สัตว์ปีกบริโภคสามารถส่งผลกระทบต่อความชื้นในอุจจาระได้โดยตรงโดยปริมาณน้ำในอุจจาระจะมีผลกระทบต่อระดับความชื้นในขี้ไก่ในระบบการผลิตสัตว์ปีก ซึ่งระดับความชื้นนั้นจะอยู่ในช่วง 15% ถึง 44%
- (Kelleher et al., 2002) แต่มีปัญหาสำคัญที่เกิดขึ้นคือการสูญเสียไนโตรเจนในรูปของแอมโมเนีย ซึ่งสามารถเกิดขึ้นได้ในระหว่างกระบวนการหมักยูเรียและกรดยูริกโดยจุลินทรีย์ (Nahm, 2003)
- ในโรงเรือนเลี้ยงไก่ แอมโมเนียที่ระเหยออกมาเป็นหนึ่งในก๊าซที่ทำให้สัตว์ปีกประสบกับความเครียดอย่างรุนแรง ซึ่งส่งผลกระทบต่อสวัสดิภาพ สุขภาพ และสมรรถภาพของไก่ในระดับที่น่ากังวล (Moore et al., 2011; van der Hoeven-Hangoor et al., 2014)
การป้องกัน NF-κB และ TNFα ไซโตไคน์ในภาวะพายุไซโตไคน์
- แพทเทิร์นโมเลกุลที่เกี่ยวข้องกับการรับรู้โมเลกุลที่เกิดจากเชื้อโรค ซึ่งเรียกว่า PAMPs (Pathogen-Associated Molecular Patterns) โดย PAMPs เป็นส่วนประกอบของแบคทีเรียที่มีแนวโน้มทำให้เกิดโรค สิ่งมีชีวิตที่มีหลายเซลล์สามารถตรวจจับ PAMPs ได้อย่างมีประสิทธิภาพ
- PAMPs ประกอบด้วยองค์ประกอบที่สำคัญ เช่น ไลโปเปปไทด์ เปปทิโดไกลแคน และกรดเทโคอิก (Salminen and Isolauri, 2006)
- นอกจากนี้ เอนโดทอกซินลิโปโพลีแซ็กคาไรด์ (LPS) ที่พบในเยื่อหุ้มเซลล์ของแบคทีเรียแกรมลบ ยังเป็นตัวอย่างที่สำคัญในการศึกษาเกี่ยวกับการตอบสนองทางภูมิคุ้มกัน (Kallapura et al., 2014)
- โดยทั่วไปแล้ว สารก่อโรค (แบคทีเรีย, โปรโตซัว, ไวรัส, หนอนพยาธิ) จะกระตุ้นการตอบสนองทางการอักเสบในโฮสต์
- ตัวอย่างเช่น ในสัตว์ปีกในบ้าน โรคค็อกซิโดสิสอาจทำให้เกิดการเนื้อเน่าและการอักเสบในลำไส้ ส่งผลให้เกิดไข้ ซึมเศร้า สมรรถภาพลดลง และอาจถึงขั้นเสียชีวิต ขึ้นอยู่กับชนิดของ Eimeria spp
ROS และ RNS และผลกระทบของพวกมันในระดับโมเลกุล
- เซลล์เม็ดเลือดขาวหลายรูปร่าง (PMN) และมาโครฟาจทำหน้าที่ต่อสู้กับเชื้อโรคเป็นแนวป้องกันแรก โดยการผลิตโมเลกุลที่มีปฏิกิริยาซึ่งสามารถกระตุ้นปฏิกิริยาออกซิเดชันหรือรีดักชัน (Qureshi, 2003; Petrone-Garcia et al., 2021)
- โมเลกุลเหล่านี้รวมถึง ROS เช่น ซูเปอร์ออกไซด์, ไฮโดรเจนเปอร์ออกไซด์, และไฮดรอกซิลเรดิคัล
- RNS ประกอบด้วยไนตริกออกไซด์และเพอร์ออกซินิไตรต์
- ทั้ง ROS และ RNS เป็นพิษอย่างมากในการต่อสู้กับผู้รุกราน
- พวกมันสามารถทะลุผนังเซลล์จุลินทรีย์ได้ง่าย ทำให้เกิดความเสียหายที่ไม่สามารถย้อนกลับได้ (Gostner et al., 2013)
- การสัญญาณภูมิคุ้มกันเริ่มต้นการผลิตโมเลกุล ROS และ RNS เหล่านี้เพื่อยับยั้งและฆ่าเชื้อโรค (Sun et al., 2020)
- อย่างไรก็ตาม เมื่อโมเลกุล ROS ทำปฏิกิริยาเกินไป พวกมันจะกลายเป็นสารพิษต่อระบบภูมิคุ้มกันที่สามารถทำลายเซลล์ของโฮสต์และเนื้อเยื่อที่อยู่ใกล้เคียง ส่งผลให้เกิดการอักเสบทั้งในท้องถิ่นและทั่วระบบ รวมถึงความล้มเหลวของอวัยวะหลายระบบ (Chen and Kevil, 2020)
- เนื่องจากเหตุนี้ การควบคุม ROS จึงเป็นกุญแจสำคัญในการหลีกเลี่ยงผลกระทบที่ไม่ดีจากการผลิตที่เกินความจำเป็นและผลกระทบที่เป็นลบ (Lian et al., 2020)
🔒 เนื้อหาเฉพาะสำหรับผู้ใช้ที่ลงทะเบียน.
ลงทะเบียนฟรีเพื่อเข้าถึงโพสต์นี้และเนื้อหาเฉพาะทางอื่น ๆ อีกมากมาย ใช้เวลาเพียงหนึ่งนาทีและคุณจะสามารถเข้าถึงได้ทันที
เข้าสู่ระบบลงทะเบียนได้ที่ aviNews
ลงทะเบียน