เนื้อหาดูได้ที่: English (อังกฤษ) Indonesia (อินโดนีเซีย) Melayu (Malay) Tiếng Việt (เวียดนาม) Philipino (ฟิลิปปินส์)
เชื้อเมตานิวโมไวรัสในนก (aMPV)
โรคทางระบบทางเดินหายใจเป็นความท้าทายที่ต่อเนื่องสำหรับผู้ผลิตสัตว์ปีกและสัตวแพทย์ เนื่องจากสัตว์ไม่แสดงอาการที่สามารถระบุได้ชัดเจน ทำให้การวินิจฉัยมีความซับซ้อนมากขึ้น
เชื้อเมตานิวโมไวรัสในนก (aMPV)
- เป็นสาเหตุสำคัญในโรคทางเดินหายใจแต่มักจะถูกมองข้ามบ่อยครั้ง
- เชื้อนี้สามารถส่งผลกระทบต่อระบบทางเดินหายใจและระบบสืบพันธุ์ ซึ่งสามารถส่งผลในการพัฒนาโรคอื่น ๆ เช่น โคลิแบซิโลซิส ซึ่งเป็นการติดเชื้อร่วมที่พบได้บ่อยที่สุดในไก่เนื้อ ส่วนในไก่งวงจะพบเชื้อ Ornithobacterium
- การติดเชื้อ Mycoplasma gallisepticum อาจยืดเวลาการจำลองพันธุ์ของไวรัส แต่ในฐานะการติดเชื้อรอง aMPV อาจทำให้การติดเชื้อ M. gallisepticum ช้าลง
การกระจายและระบาดวิทยาของ aMPV
aMPV ส่งผลกระทบต่อไก่งวงและไก่ รวมทั้งพบได้ในนกกระทา, เป็ด และนกฟาซาน
มันเป็นไวรัสที่มีเปลือกหุ้มและมีสาย RNA แบบลบ ซึ่งอยู่ในสกุล Metapneumovirus ของวงศ์ Pneumoviridae
ผลกระทบจากเชื้อ aMPV ในระดับโลกมีความสำคัญอย่างยิ่ง โดยมีการยอมรับว่ามีซับไทป์ที่แตกต่างกันถึงหกประเภท ซึ่งแต่ละซับไทป์มีการกระจายอยู่ในพื้นที่เฉพาะ
- ในขณะนี้ ซับไทป์ B ถือเป็นซับไทป์ที่พบมากที่สุดทั่วโลก แต่ทั้งซับไทป์ A และ B กลับก่อให้เกิดการระบาดในหลายรัฐของสหรัฐอเมริกา หลังจากที่ไม่พบการติดเชื้อ aMPV มาเป็นระยะเวลานาน การเข้ามาของ aMPV-A และ aMPV-B ในสหรัฐอเมริกาเมื่อไม่นานมานี้ เกิดขึ้นพร้อมกับการแพร่ระบาดของไวรัส H5N1 HPAI ที่เพิ่มขึ้นจากนกน้ำอพยพ
- ในขณะนี้ ยังไม่สามารถสรุปได้ว่าการเกิดขึ้นของสองเหตุการณ์นี้เป็นความสัมพันธ์เชิงสาเหตุหรือเป็นเรื่องบังเอิญ
- การเปลี่ยนแปลงในความชุกของซับไทป์ aMPV จาก A สู่ B และการตรวจพบ aMPV-A ในอเมริกาเหนือที่เพิ่มขึ้นในช่วงปีที่ผ่านมา เป็นสิ่งที่สำคัญและอาจสะท้อนถึงพลศาสตร์การวิวัฒนาการที่กำลังเกิดขึ้น รวมถึงการเปลี่ยนแปลงในรูปแบบการระบาดอย่างมีนัยสำคัญ
การตรวจพบเชื้อ aMPV ในกลุ่มนกอพยพในหลายประเทศได้รับการยืนยันแล้ว ซึ่งแสดงให้เห็นว่าปัจจัยนี้ควรได้รับการพิจารณาในงานศึกษาระบาดวิทยา โดยเฉพาะในเรื่องของฤดูกาลและการดูแลความปลอดภัยทางชีวภาพเพื่อป้องกันการแพร่กระจายของเชื้อ ในขณะนี้ การติดต่อเชื้อแบบแนวนอนที่เกิดจากการแพร่กระจายผ่านละอองอากาศถือเป็นเส้นทางการติดเชื้อที่พบได้บ่อยที่สุด และยังไม่มีรายงานการติดต่อเชื้อในลักษณะตั้งแต่รุ่น (แนวตั้ง)
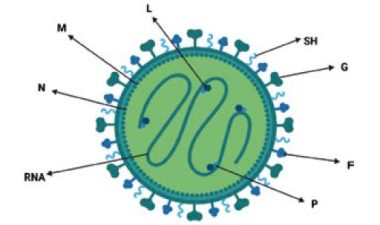
ภาพแผนผังแสดง aMPV: (G) กลัยโคโปรตีน, (F) โปรตีนฟิวชัน, (SH) โปรตีนไฮโดรโฟบิกขนาดเล็กและโปรตีนโครงสร้างอื่นๆ, (M) โปรตีนเมทริกซ์, (N) โปรตีนนิวคลีโอแคปซิด, (P) โปรตีนฟอสโฟโปรตีน, (L) RNA-พึ่งพา RNA โพลีเมอเรสและสาย RNA
ปัจจัยการเกิดโรค
ในด้านปัจจัยที่ทำให้เกิดโรคเมตานิวโมไวรัสมีความชอบพิเศษต่อระบบทางเดินหายใจส่วนบน โดยเมื่อมีการติดเชื้อจะส่งผลกระทบต่อโพรงจมูก กล่องเสียง และหลอดลม เชื้อทำให้การเคลื่อนไหวของขนขนาดเล็ก (cilia) หยุดชะงัก หรือเกิดภาวะที่ทำให้ขนเหล่านี้ไม่สามารถทำงานได้ (ciliostasis) และอาจสูญเสียขนเหล่านี้ไปทั้งหมด (desciliation) ความเสียหายที่เกิดขึ้นจะทำให้มูกไม่สามารถถูกขจัดออกจากร่างกายได้ จึงสะสมในช่องทางและโพรงต่าง ๆ ส่งผลให้เกิดอาการหลักของโรคนี้ คือ หัวบวม
- เชื้อ aMPV ก่อให้เกิดการติดเชื้อในทางเดินหายใจอย่างรุนแรงในไก่งวง ซึ่งรู้จักกันในชื่อ Turkey Rhinotracheitis (TRT) นอกจากนี้ ในกรณีของไก่ที่ไข่ เชื้อยังสามารถทำให้การผลิตไข่ลดลงได้ และสามารถแยกเชื้อจากอัณฑะของไก่หนุ่ม ซึ่งทำให้ความอุดมสมบูรณ์ลดลงร่วมกับการติดเชื้อไวรัส Infectious Bronchitis Virus.
อาการที่พบได้บ่อย ได้แก่:
- จาม
- มีน้ำมูกและน้ำตาไหล
- ตาอักเสบ (Conjunctivitis)
- บวมที่ใต้คาง (Submandibular edema)
- บวมที่โพรงไซนัสอินฟราออร์บิตัล (Infraorbital sinus swelling)
- การแตกของผิวหนัง (Cracking)
- เสียงหายใจลำบาก (Rales)
ในไก่จะทำให้เกิดอาการบวมที่โพรงไซนัสรอบดวงตาและไซนัสอินฟราออร์บิตัล คอเอียง (torticollis) การหลงทิศทาง (disorientation) และอาการเกร็งหลัง (opisthotonos) การแสดงอาการทางคลินิกอาจพัฒนาไปสู่การเปลี่ยนสีของเยื่อบุตาเป็นสีแดงพร้อมกับบวมของต่อมสร้างน้ำตา
- ภายในเวลา 12 ถึง 24 ชั่วโมงนกจะแสดงอาการบวมใต้ผิวหนังที่บริเวณหัว โดยเริ่มจากรอบดวงตา บวมเพิ่มขึ้นไปทั่วหัวแล้วจึงขยายไปยังเนื้อเยื่อใต้คางและหลังคอ
- หลังจากสามวัน ไก่อาจแสดงอาการทางระบบประสาท เช่น อาการเบื่ออาหาร (apathy) และคอเอียง (torticollis)
- ระยะเวลาการคงอยู่ของ aMPV เพียง 4 ถึง 7 วัน ซึ่งทำให้การตรวจพบไวรัสเพื่อการวินิจฉัยโมเลกุลทำได้ยาก
การฉีดวัคซีนและความดันจากการคัดเลือก
วัคซีนจากซับไทป์ A และ B มีอยู่และทั้งสองชนิดสามารถให้การป้องกันที่มีประสิทธิภาพข้ามกันได้ดี
- อย่างไรก็ตาม ปัจจุบันยังไม่มีวัคซีนใดที่ได้รับการอนุมัติให้ใช้ในสหรัฐอเมริกา มีรายงานเกี่ยวกับการเลือกสรรจากความดันวัคซีนในช่วงสองทศวรรษที่ผ่านมา ซึ่งแสดงให้เห็นว่าการป้องกันที่มีความสามารถข้ามกันระหว่างวัคซีนทั้งสองซับไทป์นั้นได้รับการพิสูจน์ แม้ว่าจะมีโอกาสที่ไวรัสจะหลีกเลี่ยงการตอบสนองของวัคซีนได้
- ดังนั้น การฉีดวัคซีนจึงควรได้รับการเสริมด้วยมาตรการรักษาความปลอดภัยทางชีวภาพและการตรวจสอบไวรัส เพื่อให้การควบคุมเป็นไปอย่างมีระบบและมีประสิทธิภาพ นอกจากนี้ยังมีรายงานที่ขัดแย้งกันเกี่ยวกับการวิวัฒนาการของไวรัส aMPV บางการศึกษาแสดงให้เห็นว่า aMPV มีอัตราการวิวัฒนาการที่ช้ากว่าไวรัส RNA ของนกชนิดอื่น ขณะที่บางการศึกษาได้ประเมินว่ามันมีอัตราการวิวัฒนาการในระดับปกติ
- ด้วยเหตุนี้ การศึกษาและการเฝ้าระวังไวรัสจึงเป็นสิ่งสำคัญในการพัฒนาวัคซีนและกลยุทธ์ในการควบคุมโรคในอนาคต
มีรายงานที่ขัดแย้งกันเกี่ยวกับการวิวัฒนาการของ aMPV
บางการศึกษารายงานว่า aMPV เป็นไวรัสที่วิวัฒนาการช้าเมื่อเทียบกับไวรัส RNA ของนกชนิดอื่น ๆ ขณะที่บางการศึกษาประเมินว่าอัตราการวิวัฒนาการของมันอยู่ในช่วงปกติ
- อย่างไรก็ตาม การวิวัฒนาการของไวรัสขึ้นอยู่กับทั้งความดันที่เกิดจากโปรแกรมการฉีดวัคซีนและประเภทของโฮสต์และสิ่งแวดล้อม ดังนั้น หลายสายพันธุ์ของซับไทป์เดียวกันสามารถหมุนเวียนในลักษณะทางฟีโนไทป์ในพื้นที่ต่าง ๆ ของโลก
- ความหลากหลายทางพันธุกรรมในลำดับที่ศึกษาได้เน้นย้ำถึงความจำเป็นเร่งด่วนในการทำการถอดรหัสพันธุกรรมทั้งหมดของไวรัสนี้เพื่อทำความเข้าใจเกี่ยวกับตัวแปรที่หมุนเวียนในสนามและวิวัฒนาการของไวรัสนี้ในช่วงเวลาต่อไป
ความสัมพันธ์ทางฟีโลเจนีติกของเชื้อ aMPV-B ได้รับการศึกษาโดยใช้วิธีการหาค่าสูงสุดของความน่าจะเป็น (Maximum Likelihood) ผ่านซอฟต์แวร์ Molecular Evolutionary Genetics Analysis (MEGA X) ซึ่งผลการวิเคราะห์แสดงให้เห็นว่า aMPV-B มีวิวัฒนาการเกิดขึ้นในยุโรปตั้งแต่การปรากฏตัวครั้งแรก
- จากการวิเคราะห์ไวรัส aMPV-B พบว่าประมาณ 40% ของตัวอย่างมีต้นกำเนิดจากวัคซีน โดยมีความคล้ายคลึงทางฟีโลเจนีติกและแสดงความคล้ายคลึงของนิวคลีโอไทด์สูงกับสายพันธุ์วัคซีนเชิงพาณิชย์ที่ได้รับอนุญาตในยุโรป
- ในขณะที่ส่วนที่เหลืออีก 60% ถือเป็นสายพันธุ์จากสนาม (field strains) เนื่องจากพวกมันแยกกลุ่มออกจากกันและแสดงความคล้ายคลึงของนิวคลีโอไทด์ต่ำเมื่อเปรียบเทียบกับวัคซีนและสายพันธุ์ที่มาจากวัคซีน ในทางตรงกันข้ามกับสายพันธุ์ที่มาจากวัคซีน สายพันธุ์จากสนามมักจะมีรูปแบบการรวมกลุ่มตามแหล่งที่มาทางภูมิศาสตร์
การทดสอบการวินิจฉัยและการค้นพบสายพันธุ์ไวรัสใหม่
ผู้เชี่ยวชาญทุกคนแนะนำให้ทำการตรวจสอบนกโดยใช้เซอโรโลยีเพื่อตรวจหาภูมิคุ้มกันด้วยการทดสอบ ELISA และตรวจหาไวรัสเพื่อระบุอัตราการระบาดของซับไทป์และกำหนดวัคซีนที่ดีที่สุดในการใช้
ชุดทดสอบ ELISA เชิงพาณิชย์ที่มีจำหน่าย ได้แก่:
- Idexx Avian Pneumovirus antibody test kit เพื่อตรวจหาซับไทป์ A, B และ C
- BioChek Avian rhinotracheitis (ART) antibody test kit เพื่อตรวจหาซับไทป์ A และ V
สามารถตรวจพบซับไทป์ของ AMPV A, B, C และ D โดยการทดสอบ PCR แบบเรียลไทม์ดั้งเดิม หรือ RT-qPCR อย่างไรก็ตาม การแยกไวรัสและการถอดรหัสพันธุกรรมในบริเวณยีน G อาจจำเป็นเพื่อระบุซับไทป์
- การลำดับพันธุกรรมของ aMPV และการแยกแยะระหว่างวัคซีนและสายพันธุ์จากสนามผ่านการวิเคราะห์ลำดับยีน G อาจเป็นเครื่องมือที่มีค่าสำหรับการวินิจฉัยที่ถูกต้อง
- ควรใช้เครื่องมือเหล่านี้อย่างสม่ำเสมอเพื่อปรับกลยุทธ์การควบคุมให้มีประสิทธิภาพยิ่งขึ้น
ตัวอย่างที่ใช้ในการวิเคราะห์ ได้แก่ การเช็ดตัวอย่างจากช่องปากและคอ, จมูก, และโพรงไซนัส ซึ่งควรส่งในสื่อขนส่ง ตัวอย่างจากจมูกเป็นแหล่งตัวอย่างที่เชื่อถือได้ที่สุดสำหรับการวินิจฉัยโมเลกุลของ aMPV ในกรณีที่นกไม่มีอาการ โดยช่องคอและหลอดลมจะเป็นทางเลือกรอง ในกรณีนกที่มีอาการจะสามารถตรวจพบไวรัสได้จากช่องคอ, จมูก และหลอดลม
การรักษาห่วงโซ่ความเย็นจากจุดที่เก็บตัวอย่างจนถึงการขนส่งไปยังห้องปฏิบัติการวินิจฉัยนั้นเป็นสิ่งสำคัญมาก
หากการขนส่งอาจใช้เวลามากกว่า 24 ชั่วโมง ตัวอย่างควรถูกแช่แข็งที่ -80°C และส่งแบบด่วนโดยใช้ถ่านแห้ง (dry ice)
การควบคุม aMPV ต้องการการระบุตัวการที่ถูกต้อง, การเฝ้าระวังทางระบาดวิทยา, การวินิจฉัยที่มีประสิทธิภาพ, โปรแกรมการป้องกันด้วยภูมิคุ้มกันที่เพียงพอ และการรักษาความปลอดภัยทางชีวภาพที่ต่อเนื่อง
A
B
รูปที่ 1. (A) ไก่งวงแสดงอาการบวมที่ไซนัสอินฟราออร์บิตัล, น้ำตาไหล และตาอักเสบ (ขอบคุณจาก ดร. Ashley Mason); (B) ไก่อายุห้าสัปดาห์แสดงอาการบวมที่หัว, บวมที่ไซนัสอินฟราออร์บิตัล, รูจมูกอุดตัน และน้ำตาไหลที่มีคราบขุ่น (ขอบคุณจาก ดร. William McRee). แหล่งที่มา: Luqman et al., 2024. Viruses 16 (4): 508.
🔒 เนื้อหาเฉพาะสำหรับผู้ใช้ที่ลงทะเบียน.
ลงทะเบียนฟรีเพื่อเข้าถึงโพสต์นี้และเนื้อหาเฉพาะทางอื่น ๆ อีกมากมาย ใช้เวลาเพียงหนึ่งนาทีและคุณจะสามารถเข้าถึงได้ทันที
เข้าสู่ระบบลงทะเบียนได้ที่ aviNews
ลงทะเบียน