La espiroquetosis intestinal aviar (EIA) es una patología que afecta especialmente a ponedoras y reproductoras.
- Se caracteriza por una bajada de puesta y diarrea con descargas cecales espumosas, causando en algunas ocasiones un importante impacto económico.
- La tendencia creciente hacia los sistemas de producción alternativos en suelo tiene como consecuencia un aumento de la prevalencia de casos y una preocupación cada vez mayor por este agente.
ETIOLOGÍA Y PATOGENIA
La EIA está causada por la colonización del ciego y del recto por espiroquetas pertenecientes a la familia Brachyspiraceae, género Brachyspira.
- Son bacterias Gram-negativas, anaerobias, con forma helicoidal, de crecimiento lento y dificultoso.
- Las especies involucradas en los procesos patológicos son Brachyspira intermedia, Brachyspira pilosicoli, Brachyspira alvinipulli y mucho menos frecuentemente Brachyspira hyodysenteriae.
- Existen otras especies que se consideran comensales y cuya presencia no causa enfermedad, como B. pulli o B.innocens.
- Es frecuente encontrar coinfección de dos o más especies en una misma explotación.
- La transmisión se produce horizontalmente por vía oro-fecal directa o indirecta.
Además, las aves silvestres, roedores, insectos o animales domésticos pueden introducir o dispersar la enfermedad, por lo que son necesarias unas buenas medidas de bioseguridad.
El periodo de incubación es variable, la colonización del ciego y el desarrollo de los signos clínicos pueden durar varias semanas.
Algunos factores predisponentes y que pueden influir en la gravedad de los signos clínicos incluyen la edad, los sistemas de producción en suelo o con acceso al exterior, el estrés, el manejo, la dieta, una elevada densidad de animales y las especies de Brachyspira involucradas.
De esta forma la espiroquetosis puede presentar diversas formas clínicas, desde una forma subclínica a procesos con sintomatología grave.
Los signos clínicos más observados son
- disminución de la producción de huevos
- diarrea con descargas cecales espumosas
Ocasionalmente se puede presentar
- aumento de la mortalidad
- disminución de los índices de crecimiento
- huevos con restos de material fecal
- disminución del tamaño del huevo
- retraso en el inicio de puesta
En los casos más graves se observan lesiones claras de tiflitis con ciegos dilatados y presencia de contenido espumoso marrón-amarillento y mucus (Imagen 2).

TÉCNICAS DIAGNÓSTICAS
Las lesiones patológicas no son suficientes para confirmar el diagnóstico. Aunque la espiroquetosis intestinal era habitualmente confirmada usando técnicas microbiológicas, las cepas de Brachyspira sp. tienen un crecimiento lento y dificultoso,
- por eso el uso de técnicas rápidas de detección como la qPCR han facilitado su diagnóstico.
Además, han permitido identificar las diferentes especies de Brachyspira presentes en la muestra, pudiendo diferenciar de esta forma los procesos patológicos de una colonización por parte de especies comensales.
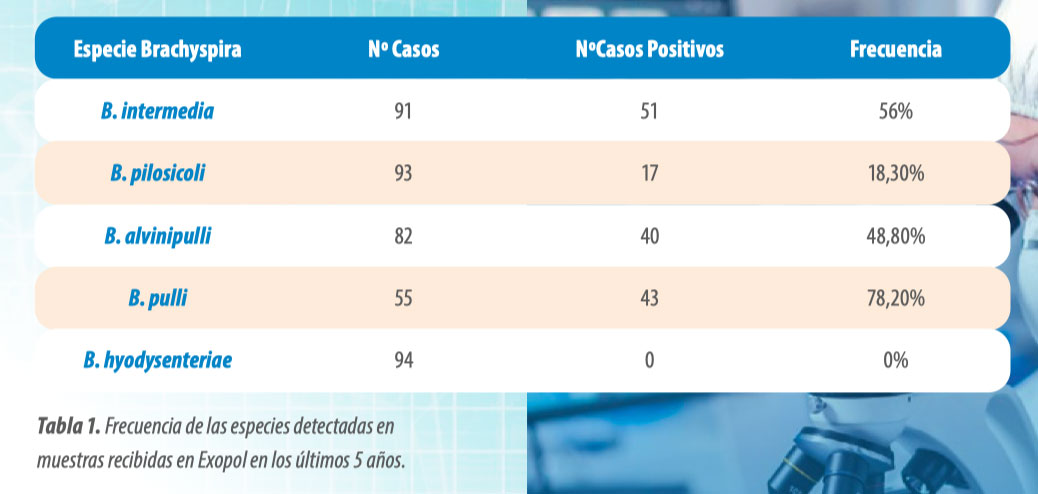
En la Tabla 1 se muestra la frecuencia de las diferentes especies detectadas en las muestras recibidas en Exopol en los últimos 5 años.
Aunque la qPCR ha facilitado mucho el diagnóstico de estos procesos, el aislamiento sigue siendo necesario para realizar los estudios de sensibilidad antibiótica.
La probabilidad de éxito del cultivo depende de la calidad de la muestra, siendo las muestras idóneas descargas cecales frescas o contenido cecal fresco.
TRATAMIENTO Y PRUEBAS DE SENSIBILIDAD ANTIBIÓTICA
El tratamiento de los procesos de EIA en las explotaciones avícolas presenta muchas limitaciones debido a la falta de productos registrados y a la escasez de productos sin tiempo de espera que puedan ser usados en ponedoras.
- Numerosos estudios describen que algunos antibióticos como la tiamulina, tilosina, lincomicina, oxitetraciclina, tetraciclina, doxiciclina o metronidazol pueden ser eficaces para el control de la espiroquetosis intestinal aviar.
- Sin embargo, la susceptibilidad antimicrobiana es variable en cada caso, y es frecuente encontrar resistencias.
Según la literatura científica se han descrito mutaciones en distintos genes de cepas de Brachyspira sp. que causan resistencia antibiótica a las familias: macrólidos, lincosamidas y pleuromutilinas, así que es necesario realizar pruebas de sensibilidad para detectar estas cepas.
Una de las técnicas que existe para estudiar la sensibilidad antibiótica de una bacteria es la concentración mínima inhibitoria (CMI).
- La CMI indica la concentración más baja de antibiótico que inhibe el crecimiento bacteriano.
- Conoceremos, además de los antibióticos sensibles, la concentración de antibióticos que debe llegar al órgano diana para que el tratamiento sea efectivo. Existen distintos métodos y uno de los más frecuentes es el método de microdilución (Imagen 4).
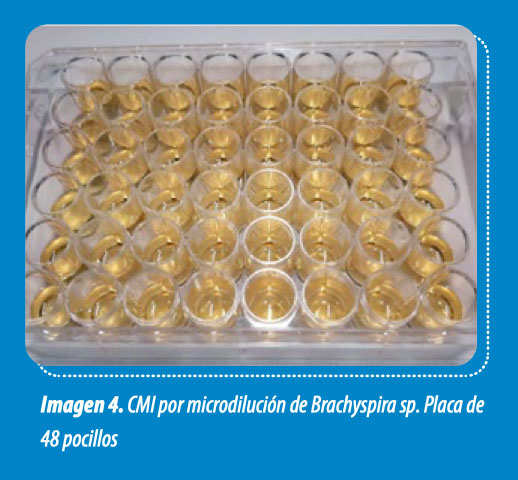
Al ser una bacteria de crecimiento difícil, las condiciones de cultivo para realizar las CMI son especiales. Se preparan diluciones de menor a mayor concentración y se distribuyen por orden en una placa de 48 pocillos (imagen 4). La incubación es más larga de lo habitual, dura 4 días, y se realiza en anaerobiosis.
- Tras la incubación se puede apreciar el crecimiento bacteriano como turbidez en el pocillo, de este modo la CMI se identificará con el pocillo con la menor concentración en el que no haya crecimiento bacteriano. Este resultado se compara con los puntos de corte clínicos para cada antibiótico.
De las diferentes especies de Brachyspira sp., de la que hay información descrita en cuanto a técnicas de sensibilidad antibiótica estandarizadas y puntos de corte clínicos es de Brachyspira hyodysenteriae, que es el agente causal de disentería porcina.
RESULTADOS DE CMI
Se han recopilado los resultados de CMI de 12 cepas de Brachyspira sp. procedentes de casos clínicos de aves de España. Las muestras fueron tomadas entre diciembre de 2018 y agosto de 2022.
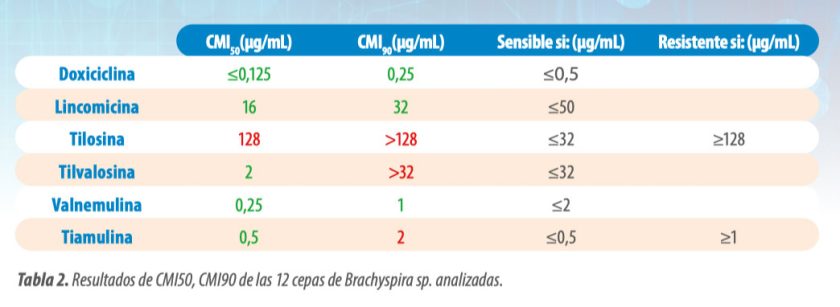
Con estos resultados se ha calculado la CMI 50 y CMI 90 (Tabla 2), que corresponden a la concentración mínima de antibiótico capaz de inhibir el crecimiento del 50% y 90% de la población bacteriana, respectivamente.
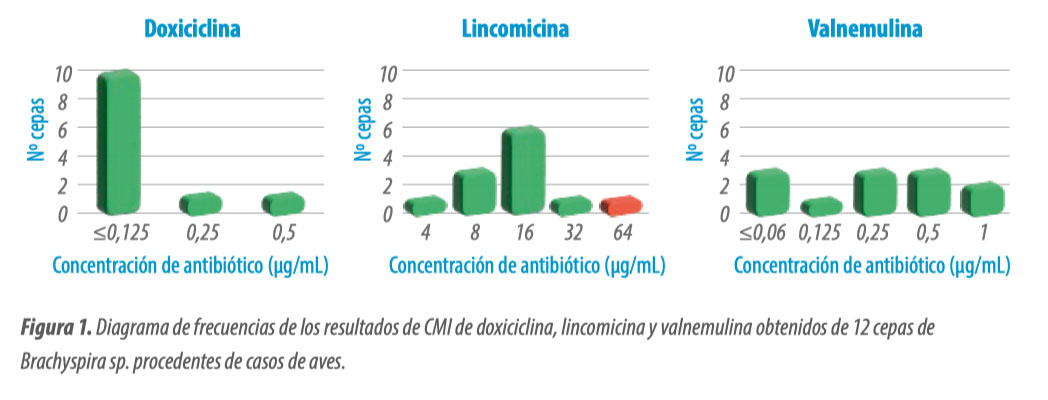
- Estos resultados nos muestran que como mínimo el 90 % de las cepas analizadas han sido sensibles a doxiciclina, lincomicina y valnemulina.
- En la Figura 1, se muestran los diagramas de frecuencias de la doxiciclina, lincomicina y valnemulina.
- El diagrama de frecuencias nos muestra el número de cepas que han tenido como resultado de CMI cada una de las concentraciones testadas.
- Todas las cepas estudiadas fueron sensibles a la doxiciclina, y solo una fue resistente a la lincomicina.
- También fueron sensibles todas las cepas a la valnemulina, este antibiótico no está registrado para aves, aunque sí que lo está para el tratamiento de Brachyspira hyodysenteriae en porcino.
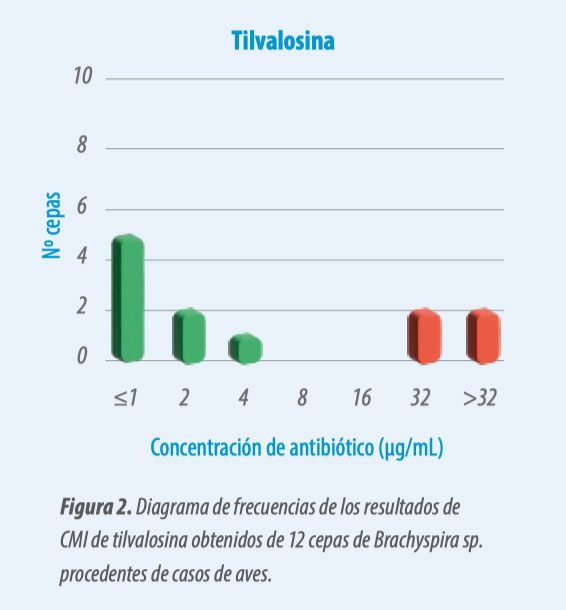
Tilvalosina
La CMI 50 de la tilvalosina se categoriza como sensible, y la CMI 90 como resistente (Tabla 2). Es posible que existan dos poblaciones de cepas diferentes, una de cepas sensibles y otra de cepas resistentes.
En su diagrama de frecuencias (Figura 2) se ve este fenómeno. La mayoría de las cepas fueron sensibles, y con unos resultados de CMI muy alejados del punto de corte.
- Sin embargo, se detectaron 4 cepas resistentes, así que sería recomendable realizar pruebas de sensibilidad antibiótica antes de instaurar un tratamiento para comprobar qué tipo de cepa es.
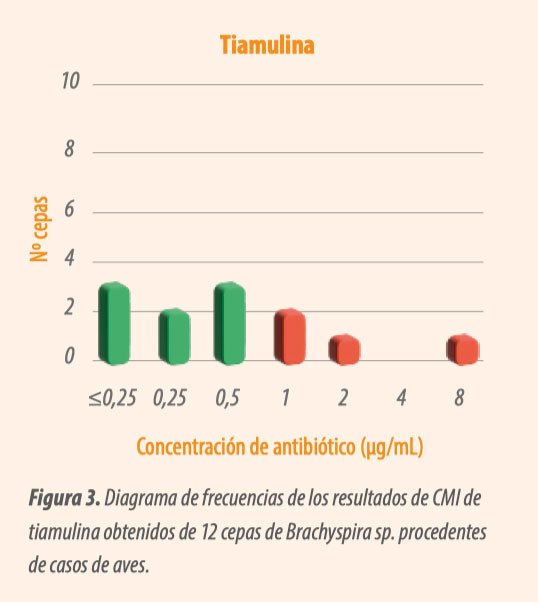
La tiamulina también presenta una CMI 50 que se categoriza como sensible, pero una CMI90 que es resistente (Tabla 2).
- En este caso se observa (Figura 3) una distribución más homogénea de las cepas. Probablemente sea la frecuente exposición a este antibiótico la que esté ocasionando el aumento de la CMI.
- De momento, para la mayoría de las cepas sigue siendo un tratamiento efectivo, pero es necesario realizar una monitorización de la sensibilidad antibiótica para observar cómo evoluciona con el tiempo y si es necesario tomar alguna medida sobre su uso.
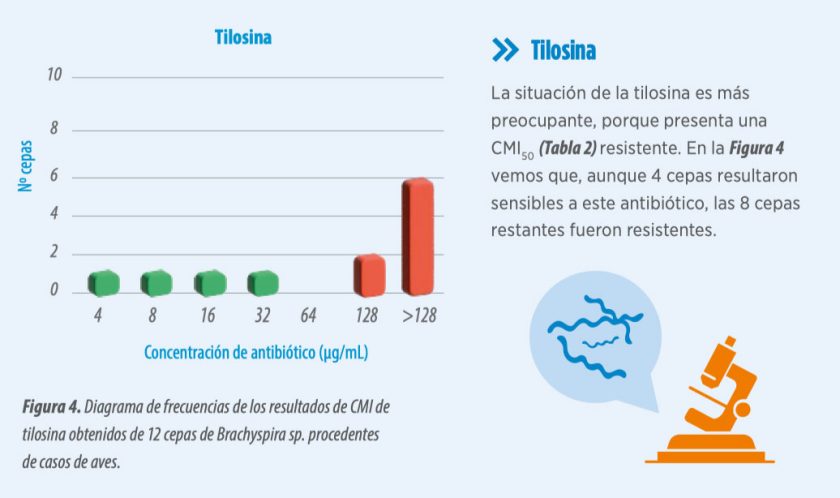
CONCLUSIONES
- Sería necesario completar este estudio con más cepas para poder elaborar una imagen amplia y real de la situación en el sector avícola.
- Además, los puntos de corte son otro de los aspectos limitantes, por lo que habría que realizar estudios científicos para obtener unos que sean específicos para las aves y las cepas de Brachyspira que las infectan.
- Con este pequeño estudio de 12 cepas se muestra un esbozo de la situación de la sensibilidad antibiótica.
- En general las cepas de Brachyspira sp. en aves son bastante sensibles a la mayoría de los antibióticos testados, pero se observan poblaciones resistentes que ponen en valor las pruebas de sensibilidad antibiótica para ayudar al veterinario en la elección del tratamiento.
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en aviNews
REGISTRARME


















