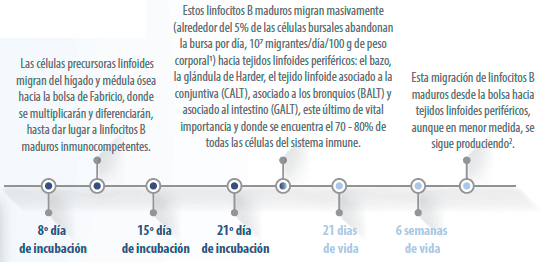
Funcionalidad de la bolsa de Fabricio
Salud Animal
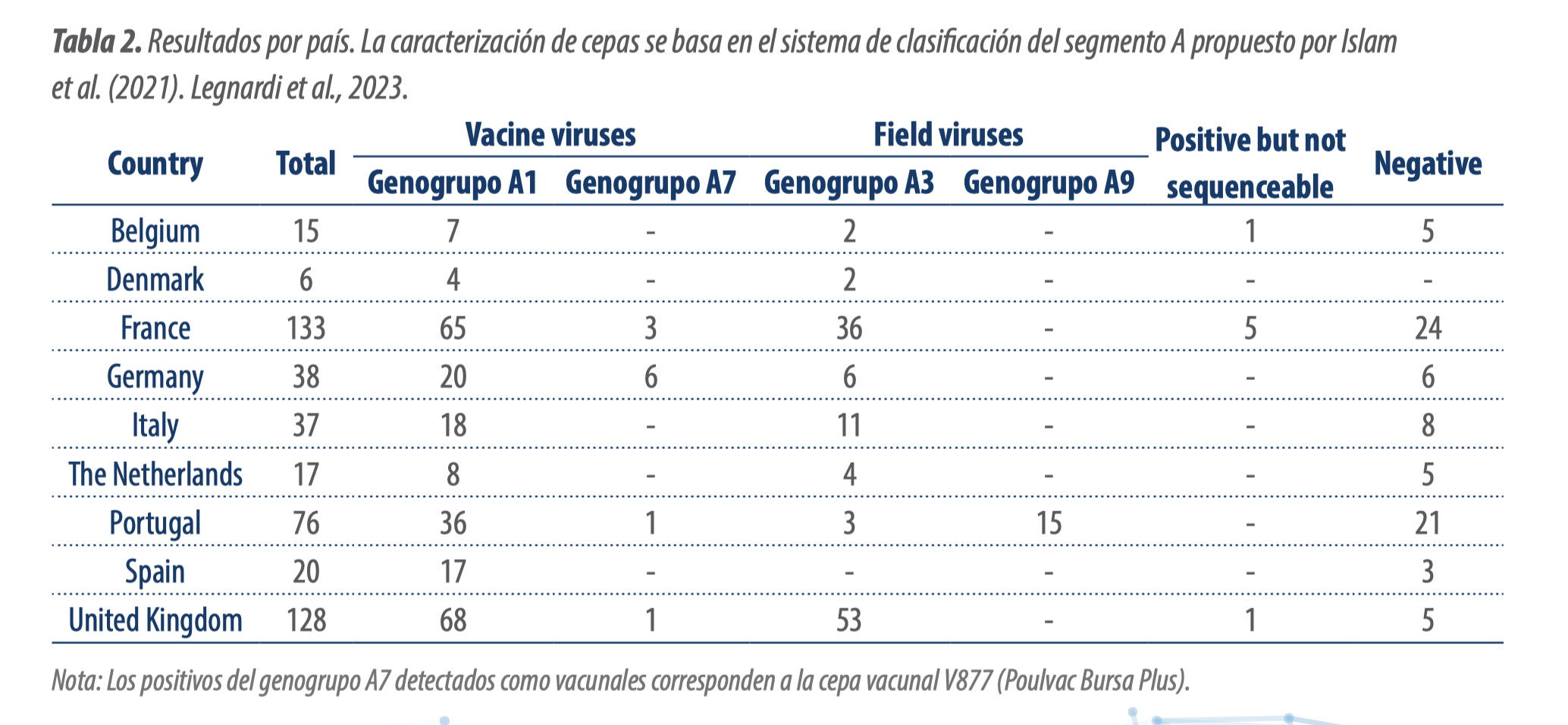
Cepas “reordenadas” emergentes de la enfermedad de Gumboro en la Europa occidental y Marruecos
Para leer más contenidos de aviNews España Diciembre 2023
Salud Animal
Para leer más contenidos de aviNews España Diciembre 2023
El reordenamiento o intercambio genético entre virus vacunales vivos atenuados y virus de campo virulentos, ha dado lugar a nuevas cepas “reordenadas” de la enfermedad de Gumboro
Estas nuevas cepas “reordenadas” se están propagando rápidamente por todo el norte y oeste de Europa, convirtiéndose en las cepas de campo más frecuentemente detectadas.
La sintomatología y lesiones observadas son muy variables dependiendo de la cepa implicada y de la eficacia vacunal; en muchos casos los lotes afectados sólo presentan malos resultados productivos, sin sintomatología ni lesiones indicativas de IBD ni aumento de la mortalidad, pero con atrofia severa de la bolsa de Fabricio y títulos elevados de anticuerpos ELISA
Causan una infección temprana, ya que rompen títulos de anticuerpos maternos altos, por lo que la correcta aplicación de la vacuna y la edad de inicio de la inmunidad vacunal son determinantes.
La enfermedad de Gumboro o Bursitis infecciosa (IBD) es una infección viral altamente contagiosa en pollos y pollitas jóvenes, siendo uno de los agentes virales inmunosupresores más importantes en la producción avícola; por ser el tejido diana del virus de Gumboro, el tejido linfoide de la bolsa de Fabricio.
Funcionalidad de la bolsa de Fabricio
La bolsa de Fabricio es un órgano linfoide primario de las aves.
Los daños en el tejido linfoide de la bolsa de Fabricio se pueden evidenciar e incluso cuantificar, tanto macroscópicamente como microscópicamente.
La enfermedad de Gumboro es causada por un virus ARN bicatenario con cápside de simetría icosaedrica, sin envoltura (IBD), perteneciente a la familia Birnaviridae. Su genoma está repartido en dos segmentos:
El segmento A (de 3,2 kb de longitud) codifica la proteína de la cápside (VP2), una proteína de andamiaje (VP3), una proteasa (VP4) y una proteína no estructural (VP5).
El segmento B (de 2,9 kb de longitud) codifica la ARN polimerasa viral (VP1).
De las cinco proteínas virales, la VP2 es la principal proteína estructural que forma la cápside viral y contiene los epítopos responsables de la generación de anticuerpos neutralizantes. Por el contrario, la proteína VP3 genera anticuerpos no neutralizantes.
De hecho, históricamente, cambios en la VP2 se han relacionado con cambios en la patogenicidad y virulencia del IBD. Sin embargo, estudios más actuales han indicado que la VP1 también desempeña un papel en la determinación de la patogenicidad.
Se conocen dos serotipos del IBDV, denominados 1 y 2. Sólo el serotipo 1 es patógeno.
Históricamente los virus de la enfermedad de Gumboro (IBDV) del serotipo 1 se clasificaban en 3 patotipos: cepas clásicas, variantes y muy virulentas. En comparación con las cepas clásicas, que fueron las primeras descritas en la década de 1960, las cepas variantes muestran diferencias antigénicas notables y se asocian principalmente con infecciones subclínicas.
Las cepas muy virulentas, a su vez, son antigénicamente similares a los virus clásicos, pero con mucha mayor patogenicidad (hasta un 50 % de mortalidad en pollitas).
Hoy en día, con el avance de los métodos moleculares de diagnóstico, esta clasificación tradicional se considera inadecuada para describir completamente la creciente variabilidad observada entre las cepas del IBDV.
Michel y Jackwood (2017), propusieron una clasificación en base a la secuencia de la región hipervariable que codifica la proteína de la cápside VP2, por ser el principal determinante de la patogenicidad.
En esta clasificación, los virus de Gumboro (del serotipo 1) se clasificaban dentro de siete genogrupos diferentes (de G1 a G7).
Actualmente, la clasificación más aceptada por ser más amplia y precisa es la clasificación propuesta por Islam et al. (2021), quien también considera una parte del gen VP1, permitiendo así la detección de “intercambio” entre ambos segmentos. Islam et al. clasifican el IBDV en:
Genogrupos VP2 (9 +1)
Genogrupos VP1
Permitiendo así una clasificación de genotipos basada en la combinación de los genogrupos del segmento A y del segmento B: A1B1, A1B2, A1B3, A2B1, etc.; actualmente se identifican un total de 15 genotipos.
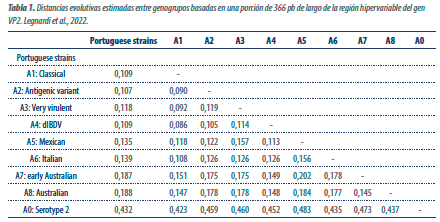
Recientemente, se demostró que un grupo de virus que circulan en Portugal posee un VP2 con características diferenciadas (ver Tabla 1), por lo que se suma un genogrupo más (llamado A9) al número total de genogrupos VP2 indicados por Islam et al.
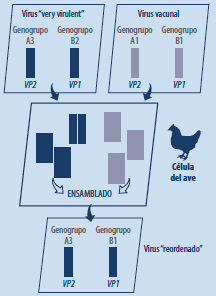
El reordenamiento es una forma de intercambio genético entre virus que se produce sólo en los virus con genomas segmentados, independientemente de si son ADN o ARN virus, si son monocatenarios o bicatenarios y de si involucran pocos o muchos segmentos.
El reordenamiento ocurre cuando dos o más virus coinfectan una sola célula huésped e intercambian segmentos (enteros) de ADN/ARN mediante el empaquetamiento o ensamblado de segmentos de diferentes orígenes en algunos virus descendientes.
A destacar que el reordenamiento y la recombinación son 2 formas distintas de intercambio genético. En la recombinación, fragmentos del material genético de 2 o más virus se mezclan o intercambian entre sí, en cualquier punto del genoma (donde haya dianas de recombinación).
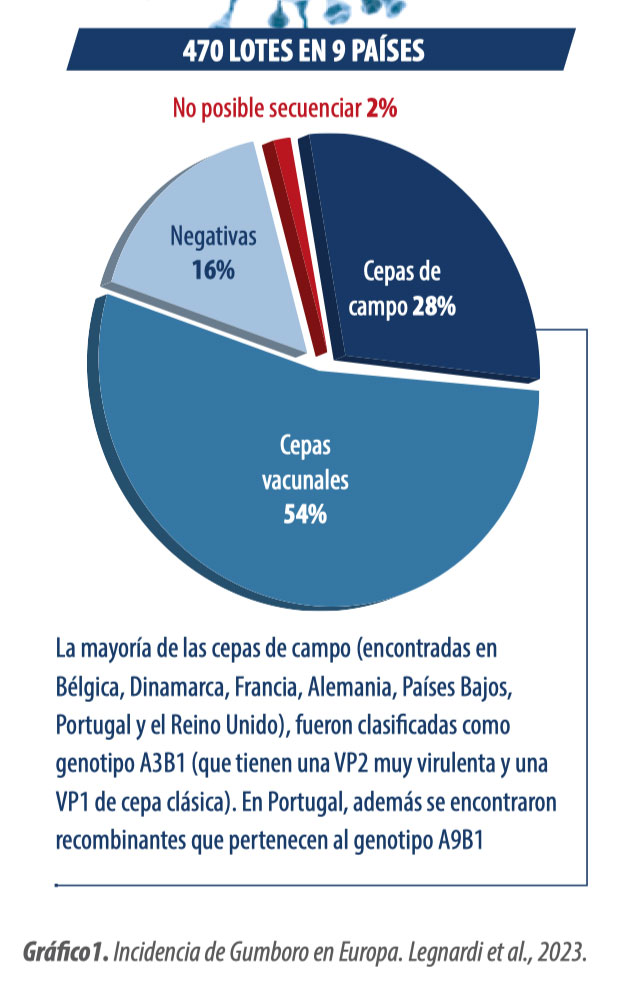
Incidencia de virus “reordenados” en Europa y Marruecos
Diferentes autores están reportando el aumento en la detección de “cepas reordenadas” en lotes con malos resultados productivos en Europa y Marruecos, de forma que se están propagando rápidamente por todo el norte y oeste de Europa, convirtiéndose en las cepas de campo más frecuentemente detectadas:
Sintomatología y lesiones de las nuevas cepas “reordenadas”
La sintomatología y lesiones observadas son muy variables dependiendo de la cepa implicada y de la eficacia vacunal; en muchos casos los lotes afectados (en aves comerciales) sólo presentan malos resultados productivos, sin sintomatología ni lesiones indicativas de IBD ni aumento de la mortalidad, pero con atrofia severa de la bolsa de Fabricio y títulos elevados de anticuerpos ELISA13 (fruto de la infección temprana).
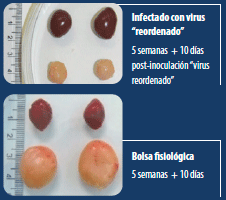
Sin embargo, Lupini et al. en el 2020, en aves SPF sin vacunar, encontraron que la cepa reordenada italiana (A3B1) causaba:

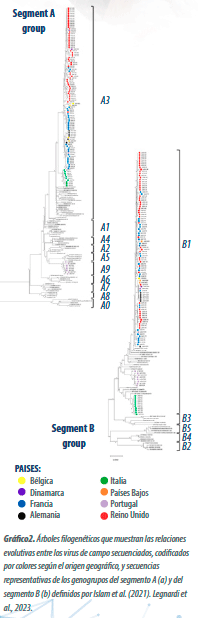
Clasificación del daño histológico bursal en la FARMACOPEA EUROPEA
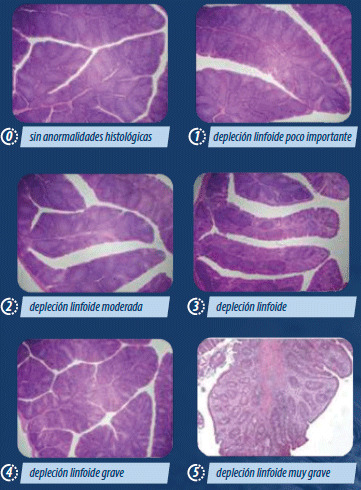
También, Pikula et al. en el 2021, en aves SPF sin vacunar, encontraron que la cepa reordenada polaca causaba:
Conclusión
Debido a la facilidad en la transmisión y larga persistencia en el medio ambiente del IBDV, el control de la enfermedad de Gumboro debe basarse en estrictas medidas de bioseguridad y la vacunación rutinaria de forma efectiva. Además, ambas medidas se deberían complementar con una valoración continua de la presión de campo y la identificación de las cepas circulantes.