Salud Animal
Colibacilosis en pollos de engorde y aves de larga vida, estrategias para un mejor control
Para leer más contenidos de Avinews Dic-Enero 2016
Salud Animal
Para leer más contenidos de Avinews Dic-Enero 2016
Aunque las mejoras, tanto en las medidas de bioseguridad de las granjas y naves, de pollos de engorde y aves de larga vida, como en el control de todas aquellas variables que pueden ser puerta de entrada o predisponer a la aparición de la misma, han logrado una disminución en la cantidad de casos que se producen actualmente, todo esto ha sucedido en tiempos donde cada vez son mayores las restricciones a nivel de la Unión Europea en el uso de antibacterianos, por lo que su control sigue siendo una preocupación.
Tomando la definición que aparece en “Diseases of Poultry” la colibacilosis se refiere a cualquier infección localizada o sistémica causada completa o parcialmente por Escherichia coli Aviar Patógena -APEC por sus siglas en inglés de Avian Pathogenic Escherichia coli-, en donde se incluye:
A diferencia de los mamíferos donde la colibacilosis es más frecuente como enfermedad primaria del tracto intestinal o urinario, en las aves domésticas es frecuentemente una enfermedad localizada o sistémica que ocurre en forma secundaria cuando las defensas del hospedador están afectadas o han sido superadas por cepas de E. coli virulentas
El impacto económico en los pollos de engorde por colibacilosis es el resultado de:
En aves, la colibacilosis, es frecuentemente una enfermedad localizada o sistémica que ocurre en forma secundaria cuando las defensas del hospedador están afectadas o han sido superadas por cepas de E. coli virulentas

Generalmente en estos brotes agudos se observa poliserositis -pericarditis, perihepatitis- y peritonitis asociadas con la presencia de huevos en formación en la cavidad peritoneal.
Sin embargo, en un estudio reciente, se han observado mayores tasas de colonización a nivel de la tráquea en las aves afectadas en un brote, sugiriendo que la colisepticemia en aves ponedoras puede ser de origen aerógeno.
Las pérdidas se producen principalmente por la mortalidad y la pérdida de la producción futura de estas aves.

Cada día se habla más de los genes de virulencia que son los responsables del potencial patógeno de una cepa determinada de E.coli.
Clasificación antigénica
Se basa en tres antígenos:
Los genes de virulencia son los responsables del potencial patógeno de una cepa
Aunque siempre se ha considerado a la E.coli como un patógeno oportunista o secundario, cada vez hay más evidencias que existen cepas que están especialmente bien adaptadas para vivir como patógenos, sugiriendo que las infecciones por APEC pueden no ser siempre secundarias u oportunistas a alguna condición predisponente.
Lo que hace distintas a estas cepas son la presencia de factores o genes de virulencia o patogenicidad.
Estos factores pueden estar localizados a nivel de los cromosomas o en islas de patogenicidad en plásmidos. Existe una gran cantidad de factores de virulencia identificados, unos son más importantes que otros, los principales los podemos agrupar así:
*Estos factores son generalmente los más evaluados en las PCR
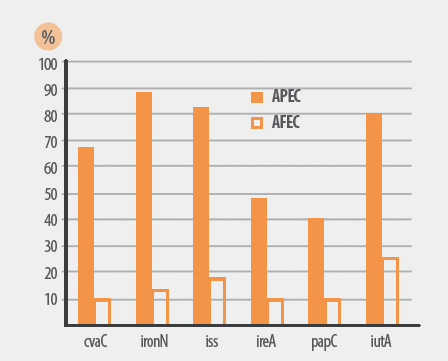
Gráfico 1. Presencia de genes de virulencia (%) en 451 aislamientos APEC vs. 104 AFEC. Rodriguez-Siek et al, Vet. Res. 36 (2005) 241-256
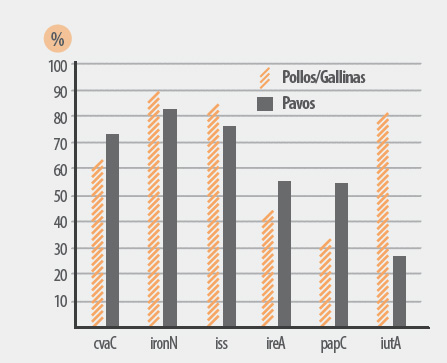
Gráfico 2. Prevalencia de genes de virulencia según especie (292 de pollos/gallinas y 122 de pavos). Rodriguez-Siek et al, Vet. Res. 36 (2005) 241-256
Puede que las infecciones por APEC no sean siempre secundarias u oportunistas
Incluye por un lado el mantener al mínimo aquellos factores que pueden predisponer a la enfermedad como valores elevados de amoníaco en la nave, así como polvo, heces, restos de plumas, etc. que pueden incrementar el número de bacterias en el ambiente.
La potabilización del agua así como la prevención de biofilm son factores de suma importancia para prevenir la colibacilosis
La potabilización del agua de consumo es de suma importancia, especialmente en aguas provenientes de pozos que pueden venir con cierto grado de contaminación, así como la prevención del biofilm en las tuberías.
Una buena forma de ayudar en la prevención de E.coli es mediante la vacunación frente a enfermedades respiratorias que hacen de puerta de entrada a los coli.
En pollos de engorde estaríamos hablando de vacunación de Bronquitis Infecciosa y Rinotraqueitis y manejar lotes negativos a M.gallisepticum y M.sinoviae.
En aves de larga vida como ponedoras o reproductoras hablaríamos de Bronquitis Infecciosa, Micoplasmosis (MG y MS), Rinotraqueitis, Coriza, Laringotraqueitis y Newcastle.
Enfermedades respiratorias como rinotraqueitis, micoplasmosis, etc. hacen de puerta para E.coli, por tanto una vacunación frente a ellas es una buena forma de prevención
Tampoco debemos olvidar a las enfermedades inmunosupresoras que comprometan el sistema inmune del ave (Gumboro, Marek, Reovirus, Anemia Infecciosa, adenovirus, etc).
Podemos resumir en tres tipos de vacunas las herramientas que han estado o están disponibles en el mercado español:
• Vacuna inactivada comercial
Esta vacuna está dirigida a la protección pasiva de los pollos de engorde a través de los anticuerpos maternos por medio de la vacunación de las reproductoras. La vacuna contiene una suspensión del antígeno fimbrial F11 y de la toxina del antígeno flagelar FT. Actualmente no se comercializa en España.
• Vacunas vivas
Solo hay una vacuna comercial* registrada en la Unión Europea y a nivel mundial, que está basada en una cepa mutante O78 según la clasificación clásica. Se ha demostrado en ensayos de laboratorio la protección cruzada frente a los serotipos O1, O2 y O18.
• Vacunas autógenas
Mejor conocidas como autovacunas, por tener que ser elaboradas con aislamientos de cepas de la explotación de destino de la misma. Consisten fundamentalmente en un elevado número de bacterias inactivadas re-suspendidas en un adyuvante, para esto se multiplican las cepas de interés en un medio adecuado, se inactivan (calor, formol, timerosal, ultrasonidos) y se mezclan con el adyuvante (aceite mineral, hidróxido de aluminio), sin embargo la inactivación de las bacterias generalmente produce liberación de toxinas de la membrana bacteriana (lipopolisacáridos).
Estas toxinas pueden ser responsables de generar un cuadro febril posterior a la aplicación de la vacuna y que dura varios días y también podrían ser responsables junto a los adyuvantes, de producir una reacción local en el sitio de inyección. Por ser inactivadas necesitan ser inyectadas con el consiguiente manejo y estrés a las aves. Estas vacunas producen una protección homóloga a las cepas que contienen, por lo que si la cepa de desafío no está incluida en la vacuna, no va a haber protección cruzada contra ella.
Las vacunas autógenas producen una protección homóloga a las cepas que contienen, no dando lugar a protección cruzada si la cepa desafío no está incluida en la vacuna
Generalmente se incluyen alrededor de cinco aislamientos distintos a los que se les ha identificado como portadores de un gen o factor de virulencia, usualmente el del sideróforo de la aerobactina. El tiempo requerido para elaborar una autovacuna de coli desde el momento de la recepción de las muestras actualizadas de la explotación es de unas 6 a 8 semanas.
La inmunidad conferida por las vacunas inactivadas es eminentemente humoral. Aunque en la gran mayoría de los casos solo se aplica una dosis en aves de larga vida, la recomendación es de aplicar dos dosis durante la recría.
La vacuna viva comercial registrada en la Unión Europea y a nivel mundial está basada en una cepa mutante O78. Además, se ha demostrado en ensayos de laboratorio la protección cruzada frente a los serotipos O1, O2 y O18 El desafío fue convertir un organismo virulento en una vacuna segura que protegiese contra la enfermedad clínica.
El aislamiento original fue realizado de un caso severo de colibacilosis en aves, la cepa es definida según la tipificación clásica como O78:K80, fue cultivada en el laboratorio y demostró producir los inmunógenos esenciales a nivel de la pared celular y flagelos. Sin embargo el aislamiento poseía muy pocos de los genes de virulencia típicos de muchos APEC.
La cepa se atenuó por medio de una delección de una porción del gen aroA, responsable de la síntesis de los aminoácidos aromáticos por la bacteria, esta delección restringe su replicación in vivo a un período corto de tiempo pero permite a los macrófagos procesarla, permitiendo la elaboración de una respuesta inmune.
Esto también restringe su supervivencia en el medio ambiente. En una vacuna viva experimental ensayada en Israel, también se demostró que confería protección cruzada frente a varios serotipos distintos al de la vacuna (Experimental vaccination of Young chickens with a live, non-pathogenic strain of Escherichia coli, A. Frommer, Avian Pathology, 1994).
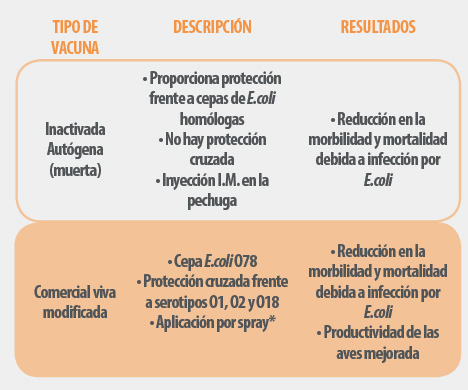
Tabla 1. Adaptado de: Hy-Line Technical Update “Colibacilosis in Layers: an overview” 2014 *Recientemente ha sido aprobada la administración en el agua de bebida en el registro europeo.
Respuesta Inmune después de la administración de la vacuna viva
En un ensayo controlado realizado en la Universidad Federal de Paraná (Brasil), en conjunto con el laboratorio Imunova Análises Biolígicas LTDA y Zoetis Brasil (“Effect of Spray Escherichia coli vaccine on the Immunity of Poultry”, Avian Diseases, 57:671-676, 2013), se evaluó la respuesta inmune periférica en pollos de engorde comerciales como resultado de la vacunación con vacuna viva. El objetivo de este estudio fue entender los mecanismos por medio de los cuales se genera una respuesta inmune como resultado de la aplicación de esta vacuna, ya que estudios previos con esta vacuna han demostrado la capacidad protectora de la misma pero ninguno ha evaluado el mecanismo por medio del cual esto se produce.
Para ello se evaluaron diversas subpoblaciones celulares en sangre periférica. Por los cambios observados en algunas subpoblaciones a distintos tiempos post-vacunación es posible inferir que la respuesta celular es relevante en el efecto protector de la vacuna, como se midió por la cantidad de células CD8 activadas y posiblemente células memoria, así como la producción de anticuerpos mucosales, que pudo observarse por la concentración de células CD4TCRVβ1+.
En un estudio realizado para medir la respuesta inmune de la vacuna viva y de una vacuna inactivada en pavos para el control de APEC (“Immune responses associated with homologous protection conferred by comercial vaccines for control of Avian Pathogenic Escherichia coli in turkeys”, Sadeyen et al. Veterinary Research, 2015, 46:5), se observó que la vacuna viva produjo un incremento significativo en inmunoglobulina IgY de suero específica contra APEC en pavos, así como la inducción de una respuesta Th2 en el bazo que se corresponde con unos niveles elevados de anticuerpos específicos contra APEC.
Indudablemente, todavía queda mucho por conocer sobre las interrelaciones entre el hospedador, las APEC y los mecanismos por medio de los cuales las diversas vacunas existentes protegen frente a los desafíos
Sin embargo, los productores deben valorar la protección que confieren las distintas vacunas, pero también la vía de aplicación de las mismas, así como los posibles efectos negativos que puedan tener en las aves.
Las vacunas vivas de nuevo desarrollo contribuyen con la moderna producción avícola por sus características de ofrecer protección cruzada frente a distintos serotipos, así como su facilidad de aplicación ya sea por spray o a través del agua de bebida.