Para leer más contenidos de Avinews Septiembre 2014
Para leer más contenidos de Avinews Septiembre 2014
Por Joan Freixes, CENAVISA, S.L.
Las etapas del ciclo de vida de un medicamento van desde su elaboraciónhasta la administración final a los animales. Precisamente, es esta última etapa uno de los puntos críticos del ciclo puede condicionar el éxito o el fracaso de un tratamiento terapéutico.
El agua es capaz de solvatar sustancias iónicas como las sales o meléculas como la glucosa a través de puentes de hidrógeno
Químicamente la molécula de agua es muy sencilla. Está constituida por dos átomos de hidrógeno y uno de oxígeno, dispuestos espacialmente como un dipolo, es decir, con la carga eléctrica repartida asimétricamente. Esta propiedad es la responsable del poder disolvente del agua, capaz de solvatar sustancias iónicas como las sales, por interacciones de tipo electrostático, o moléculas como la glucosa, por ejemplo, a través de puentes de hidrógeno.
-Antes de analizar las posibles causas que influyen en la estabilidad de un medicamento en el agua de bebida, conviene tener en cuenta una serie de consideraciones:

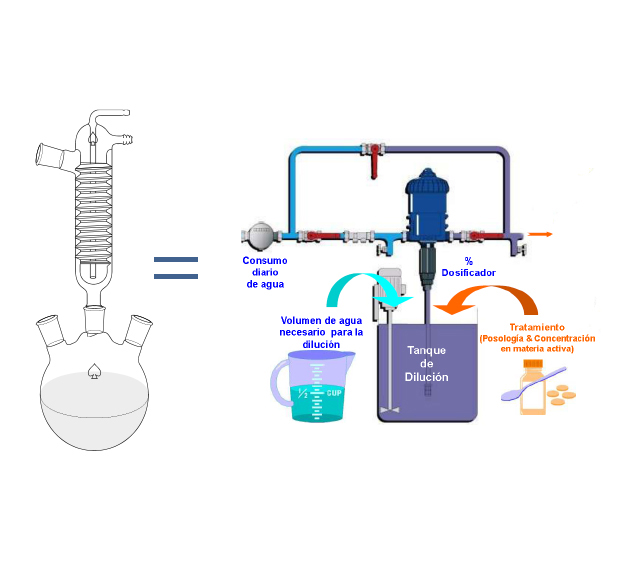
Figura 2. Dosificador de agua

Figura 3. Leyes de la cinética química
En ocasiones se atribuye el fracaso de un tratamiento terapéutico a la falta de eficacia de los medicamentos. Sin embargo, si analizamos las posibles causas que afectan su estabilidad en el agua, nos daremos cuenta de los múltiples factores que pueden alterar un medicamento y que pueden ser la causa de la escasa respuesta terapéutica. Cuando un medicamento está disuelto en el agua, las moléculas de los fármacos que lo componen son susceptibles de interaccionar con los elementos ambiambientales, que provocan un bombardeo constante que altera su estructura química, como resultado de diferentes reacciones de transformación.

Figura 4. Acción de los agentes ambientales sobre los fármacos disueltos.
Algunos fármacos reaccionan con estos iones para formar complejos de coordinación insolubles. A continuación se describen distintos ejemplos.
-El enrofloxacino es una fluoroquinolona ampliamente utilizada en avicultura. Disuelto en aguas muy duras, interacciona con los iones divalentes Ca2+ y Mg2+ formando complejos de coordinación insolubles,por cesión de pares de electrones de los átomos de oxígeno de los grupos carboxilo del enrofloxacino a orbitales d vacíos del ión Ca2+.
–Dr. SUMANO comprobó como disminuía la absorción del enrofloxacino administrado a pollos por vía oral en el agua de bebida a medida que aumentaba la dureza total del agua. Se encontraron diferencias estadísticamente significativas en la concentración sérica máxima (Csmax), en el área bajo la curva (AUC) y en la semivida de eliminación, con valores de 3.51 µg/ml, 26.21 y 0.072, respectivamente, en aguas blandas (16.5 ppm CaCO3) y 2.22 µg/ml, 13.58 y 0.069 en aguas duras (195 ppm CaCO3). La biodisponibilidad del fármaco enrofloxacino se redujo drásticamente en aguas duras un 50%.
 Imagen 1.- Vista del complejo de coordinación enrofloxacino-Ca preparado en el laboratorio
Imagen 1.- Vista del complejo de coordinación enrofloxacino-Ca preparado en el laboratorio-La doxiciclina, como el resto de las tetraciclinas (oxitetraciclina, tetraciclina y clortetraciclina) de su grupo, posee una estructura química plana con múltiples grupos funcionales con átomos de oxígeno, capaces de ceder pares de electrones a los orbitales d vacíos de los iones Ca2+ y Mg2+, formando complejos de coordinación insolubles en agua.
Estos inconvenientes pueden corregirse adicionando al depósito del dosificador que contiene el concentrado una cantidad de ácido cítrico
La formación de estos complejos de coordinación es un proceso reversible y de acuerdo con la ley de equilibrios químicos, como la constante de estabilidad de formación de complejos de calcio del ácido cítrico es 4.68 y es superior a la del enrofloxacino y la doxiciclina, el equilibrio se desplazará de forma que el ácido cítrico se combine con los iones Ca2+ y Mg2+ del agua formando los respectivos complejos de coordinación, y liberando el enrofloxacino y la doxiciclina, estabilizando la solución acuosa.
El pH puede inducir, por catálisis ácida o básica, la hidrólisis de algunos fármacos. Las aguas duras tienen un pH en un intervalo de 7.5 – 8.2.
-La amoxicilina, en solución acuosa, presenta dos posibles mecanismos de degradación, ambos inducidos por catálisis básica y cuyo factor limitante es su concentración en agua. El intervalo de pH de mayor estabilidad de la amoxicilina es de 5.8 – 6.5 .
En aguas muy duras será muy conveniente acidificar la solución con amoxicilina para ajustar la disolución en esta franja de pH.
Acelera los procesos de degradación de los fármacos. Cada 10º C de aumento de temperatura duplica la velocidad de reacción. En verano, con el aumento de la temperatura, los fármacos se alteran más rápidamente.
Puede reaccionar con un determinado fármaco provocando su oxidación. Los procesos de oxidación son catalizados por la luz, los metales pesados y el calor.
La mezcla de dos o más medicamentos puede provocar una alteración de su estabilidad. Medicamentos con distintas características ácidas y básicas, presentan incompatibilidades cuando se mezclan en el agua. Un ejemplo que ilustra lo dicho es la abundante precipitación que se produce cuando se mezclan una solución de enrofloxacino con una solución de doxiciclina hiclato.
Es muy importante controlar la calidad bacteriológica de las aguas en la sanidad de los animales, puesto que constituye un factor de desestabilización de algunos fármacos disueltos en ellas y como causa de la formación de biofilm en las conducciones y el sistema del agua de las granjas. Preservar la calidad bacteriológica de las aguas lleva consigo la utilización de agentes potabilizadores como el cloro gas, los hipocloritos y los peróxidos (peróxido de hidrógeno). Estas sustancias son agentes oxidantes fuertes, con unos elevados potenciales oxidación-reducción.
Como ejemplo de desinfectante bactericida hablaremos del cloro y en especial su forma activa en medio acuoso, el ácido hipocloroso (HClO), que penetra fácilmente en la célula bacteriana a través de la membrana citoplasmática, actuando sobre las proteínas y los ácidos nucleicos de los microorganismos, oxidando los grupos sulfhidrilo y atacando los radicales amino.
Las diferentes sustancias presentes en el agua, como la materia orgánicay otros contaminantes, influyen en la demanda de cloro. Por ello es necesario agregar suficiente cloro, no solo para destruir los microorganismos, sino también para compensar el cloro consumido por esas sustancias.
“Resulta fácil pensar que si una molécula de cloro es capaz de reaccionar con un grupo amino de una proteína para formar una cloramina durante la potabilización del agua, también podrá reaccionar con grupos amino secundarios y terciarios de algunos fármacos disueltos en ella”
Weinberg ha estudiado la acción del cloro libre libre en la estabilidad de algunos fármacos, en concreto con la doxiciclina y el enrofloxacino y comprobó la formación de los respectivos derivados clorados de estos antibacterianos. La lincomicina disuelta en agua forma el derivado sulfóxido en presencia de un exceso de cloro libre. La sulfametacina se transforma en el derivado 5-halogenado y la trimetoprima, por su parte, reacciona formando un derivado triple halogenado.
Como se observa en la Tabla 1 la colistina se produce una pérdida del 33% y con el enrofloxacino un 10%. En el resto de los antibacterianos la interacción es menos importanteSi expresamos la dosis terapéutica de algunos antibacterianos en lugar de mg/L en concentración milimolar (mmol/L) y consideramos que todo el cloro residual de 1 ppm, equivalente a 0.014 mmol/L reacciona completamente con ellos, observamos los mmoles de fármaco que reaccionan por mmol de cloro.

Tabla 1.– Dosis terapéutica de algunos antibacterianos considerando el cloro residual de 1ppm .
Hay que tener en cuenta que cada potabilizador interaccionará con los fármacos a través de mecanismos distintos y que la velocidad de esta reacción dependerá de varios factores, como la concentración de las sustancias reactivas, el pH, la temperatura, etc.
Al hacer un tratamiento terapéutico en el agua de bebida, se tendría que eliminar únicamente la carga bacteriana, sin añadir potabilizador en exceso que pudiese originar la interacción con el medicamento.
El pH ácido provocado por los acidificantes, puede inducir, por catálisis ácida, la degradación de algunos fármacos.
-PAESEN comprobó que en medio ácido la tilosina A, que es el factor mayoritario de la tilosina, se descompone en tilosina B y en medio neutro y alcalino se descompone en el aldol de la tilosina A.
Cuando a una solución de doxiciclina le da la luz, con el tiempo toma un color rojizo característico debido a la formación de una quinona.Radiación lumínica:cataliza determinados procesos de oxidación de fármacos.
Un agua sanitariamente no potable puede ser la causa de procesos infecciosos en los animales y el origen de la formación de biofilm en las conducciones.
Desde otro punto de vista, algunos microorganismos producen enzimas (β-lactamasas) que son capaces de inactivar un fármaco.
Poder garantizar la estabilidad de un fármaco disuelto en el agua de administración a los animales no resulta fácil debido a los múltiples factores que la pueden alterar, como ya se ha visto anteriormente. En estas condiciones, no se puede asegurar que se alcancen los niveles terapéuticos necesarios de fármaco para sanar a los animales y como resultado, se achaque la falta de eficacia del medicamento a su calidad.
Es muy importante que el ganadero o el avicultor conozca las características del agua de suexplotación: la dureza, el pH, su calidad bacteriológica. Con este conocimiento se podrán prever las medidas que se deban tomar para garantizar la estabilidad del medicamento disuelto en ella.
Como conclusión final, insistir que la correcta administración de un medicamento, al final, economiza el coste de un tratamiento.
BIBLIOGRAFÍA