Contenido disponible en: Português (Portugués, Brasil)
A pesar del fortalecimiento de medidas de bioseguridad en la industria avícola comercial global, el virus de la influenza aviar (VIA) sigue siendo y será una de las enfermedades respiratorias más importantes en la producción avícola.
Este virus posee una capacidad de variación excepcional y por medio de mutaciones puntuales “drift” y recombinaciones “shift” es capaz de escapar de la respuesta inmune del huésped y hacerse mas efectivo en el medio ambiente. La oficina internacional de epizootias (OIE) mantiene la información acerca de brotes de IA de alta patogenicidad en los países miembros. Estos brotes se han dividido en dos desde el 2005 al 2018.
- El primero abarca desde Enero de 2005 a Diciembre de 2012
- El segundo de Enero de 2013 a Agosto de 2018.
Si comparamos los dos brotes, el numero de países afectados es casi constante, de la misma manera el numero de eventos reportados es comparable. Lo que si ha cambiado es la diversidad de subtipos actuantes, los cuales se han triplicado (Tabla 1).
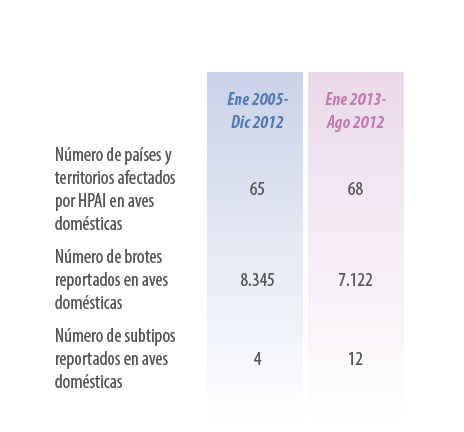
Tabla 1. Comparación entre las dos ultimas panzootias de influenza aviar de alta patogenicidad. Numero de eventos, países afectados y diversidad de las cepas actuantes
En Norte América en 2015, el virus de alta patogenicidad azotó severamente la industria avícola: En EEUU, mas de 7 millones de pavos comerciales y 40 millones de ponedoras fueron sacrificados a fin de controlar el brote. En México, cepas endémicas de IA H5N2 y H7N3 se han establecido y la vacunación es parte de la estrategia de prevención de esta enfermedad. Últimamente H7N3 de alta patogenicidad ha recrudecido el virus mientras la cuarentena y despoblación controlada son usados a manera de controlar estos brotes.
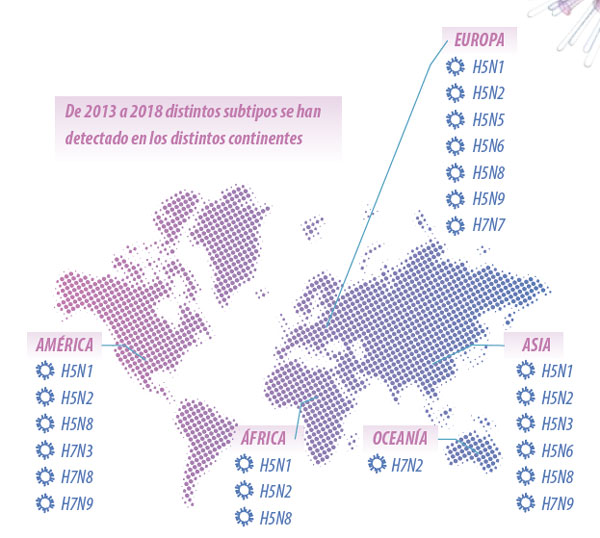
Figura 1. Distribución de los subtipos de IA de alta patogenicidad en aves domesticas en los distintos continentes.
Los estudios relacionados con IA se han enfocado por años a estudiar la relación entre el patógeno y el huésped, muy poco se ha estudiado la relación entre el patógeno y el medio ambiente avícola. La persistencia de este virus en parvadas de aves y su medio ambiente, determina el éxito en el control y erradicación de esta enfermedad.
Mientras en brotes de alta patogenicidad, la bioseguridad y pronta eliminación de las aves afectadas es la premisa para la erradicación, los brotes de baja patogenicidad se han caracterizado en los últimos años por ser controlados mediante bioseguridad y comercialización controlada. Como ejemplo práctico brotes de IA de baja patogenicidad en pavos en California siguen una dinámica similar. La seroconversión demora entre los 8 y 12 días después de su primera detección molecular. Al cabo de 24 días después de su primera detección el virus ya no es detectable por RT-PCR. Esta dinámica permite enviar estas aves a mercado libres del virus de baja patogenicidad (Dr. Charles Corsiglia, Foster Farms, comunicación personal).
Esta estrategia requiere de una férrea bioseguridad ya que cualquier error puede desencadenar la diseminación del virus.
A pesar de ser un virus envuelto, que en condiciones experimentales puede ser eliminado fácilmente, en condiciones de terreno y especialmente en galpones de aves, el virus es capaz de persistir hasta dos días en cama reusada de pollo broiler y pavos y mas de cuatro días en el guano (estiércol) de gallina ponedora, como fue reportado en la edición de aviNews de Marzo, 2017 y en Avian Diseases (Hauck et al., 2017).
En este articulo, nos enfocaremos en:
- El efecto del re-uso de cama en la persistencia del virus de alta y baja patogenicidad
- El efecto de acidificantes sobre el virus de baja patogenicidad
- La incidencia de las temperaturas de compostaje en la sobrevivencia del virus.
Efectos del re-uso de cama en la persistencia del virus de IA de alta (HP) y baja (LP) patogenicidad
El objetivo de este trabajo fue investigar si el origen y el número de uso (ciclos) del material de cama usado en galpones de pollo broiler y pavos, influye en la persistencia del virus influenza de alta (H5N8) y baja patogenicidad (H6N2). Para esto, la cama de pollo broiler de uno y once ciclos de uso y cama de pavo de uno y cuatro ciclos de uso fueron contaminadas con 105,75 EID50 por ml de cada virus por separado.
Las camas infectadas y no infectadas (controles) fueron muestreadas colectando 5gr de cada cama cada 12 horas y hasta las 96 horas. Previa detección molecular de la presencia del virus en cada muestra de cama y su cuantificación por un RT-PCR cuantitativo, las muestras fueron procesadas e inoculadas en huevos embrionados libres de patógenos específicos.
Después de dos días de la inoculación el líquido alantoideo fue obtenido y el virus detectado por la misma técnica molecular cuantitativa. Cuando la cantidad de partículas virales obtenidas del líquido alantoideo superaron la cantidad de virus en la muestra de cama, se asumió que virus se encontraba vivo y era capaz de multiplicarse (Figura 2).
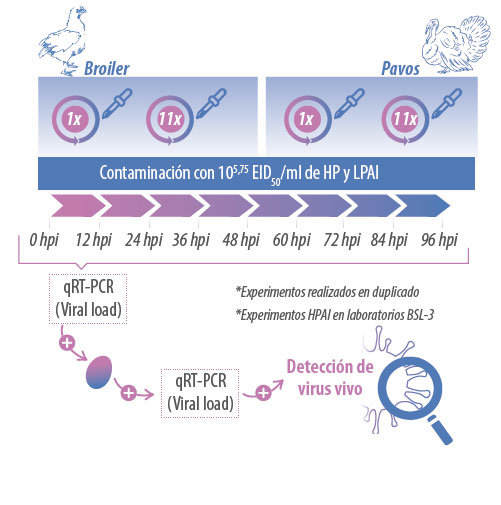
Figura 2. Diseño experimental para la detección de partículas virales vivas en muestras de cama contaminada
Los experimentos que involucraron virus de alta patogenicidad (H5N8) fueron desarrollados en un laboratorio para patógenos selectos (BSL-3) en el California Animal Health and Food Safety laboratory (CAHFS). Estos experimentos fueron desarrollados en duplicado. Como lo muestra la tabla 3, el virus de baja patogenicidad persistió menos de 24 horas en la cama testeada excepto en la cama de pollo broiler usada por un ciclo (B1) donde persistió menos de 36 horas.
El virus de alta patogenicidad persistió menos de 72 horas en la cama testeada, excepto en la muestra de cama de pavo de un ciclo de uso (P1) donde persistió menos de 60 horas. La repetición del experimento confirmo los resultados anteriores. Como conclusión podemos ver que el numero de ciclos de uso de las camas testeadas parece no tener incidencia en la persistencia del virus de la IA.
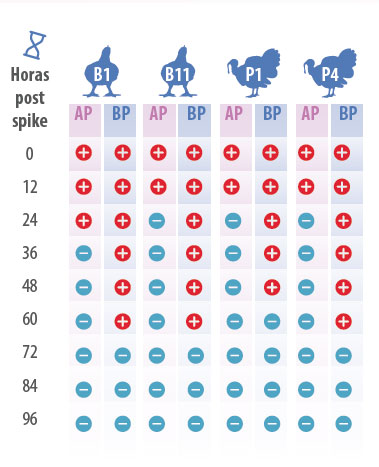
Tabla 3. Persistencia del virus de IA de alta (HP) y baja (LP) patogenicidad, en cama de broiler de un ciclo (B1), once ciclos (B11) y cama de pavo de un ciclo (P1) y de cuatro ciclos (P4) a los tiempos de muestreo después de la contaminación.
Efectos del uso de acidificantes en la cama de aves de corral, en la persistencia del virus de IA de baja patogenicidad
El objetivo de este trabajo fue investigar si el uso de acidificantes comerciales para el control del amonio en galpones de aves reduce la persistencia del virus de IA de baja patogenicidad. Usando un diseño experimental similar al del experimento anterior (Figura 3) se probaron los efectos del acidificante en el virus. Este experimento fue desarrollado en duplicado.

Figura 3. Grupos experimentales
El acidificante inactivó las partículas virales en la cama de broiler. El virus de baja patogenicidad persistió al menos 8 horas en la cama de broiler no tratada. No se detecto un efecto del acidificante en la cama de pavo, el virus persistió de igual manera en los grupos con y sin acidificante (Tabla 4). Esto puede deberse a la humedad en la cama de pavo la cual fue considerablemente alta comparada con la humedad de la cama de pollo broiler antes del experimento (~55% en la cama de broiler comparado con ~79% en la cama de pavo).
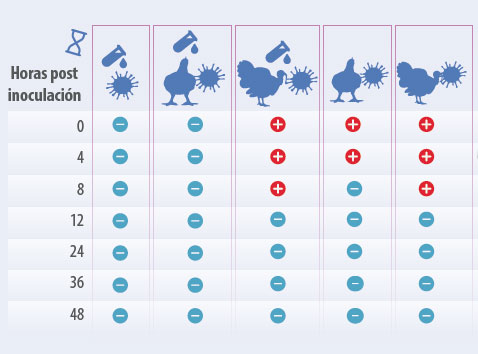
Tabla 4. Detección de virus vivo LP (H6N2) después de¡ aislamiento viral en huevos libres de patógenos específicos

Inactivación del virus influenza de baja patogenicidad en mortalidad infectada y tratada con temperatura
El objetivo de este trabajo fue el de investigar si las temperaturas de compostaje son capaces de reducir la carga viral e inactivar el virus de IA de baja patogenicidad. Macerado de pollos, cama de broiler, y una combinación de macerado de pollo y cama de broiler fueron contaminados con 105 EID50/ml de IA de baja patogenicidad (H6N2). Cada uno de estos sustratos fueron sometidos a una temperatura de 50 °C y 60 °C en un baño de agua, para medir el efecto de la temperatura en la persistencia viral. PCR cuantitativo fue usado para determinar la cantidad de virus antes y después de la inoculación en huevos y su persistencia (Figura 4).
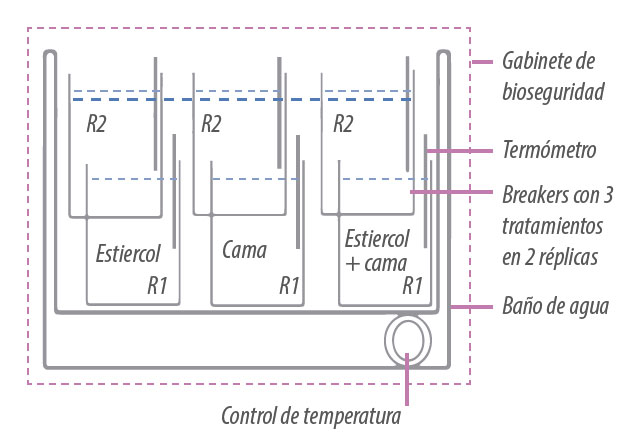
Figura 4. Diseño del baño de agua que provee temperaturas de compostaje a los distintos sustratos contaminados con IA de baja patogenicidad
Influenza aviar de baja patogenicidad fue detectada en todos los grupos después de ser contaminados a 50°C. Media hora después de la contaminación, el virus vivo fue solo detectado en el grupo que contenía solo la cama de broiler. A 60ºC, el virus vivo fue detectado al momento de la contaminación solo en los grupos macerado de pollo + cama de broiler y cama de broiler. La repetición del experimento confirmó estos resultados.
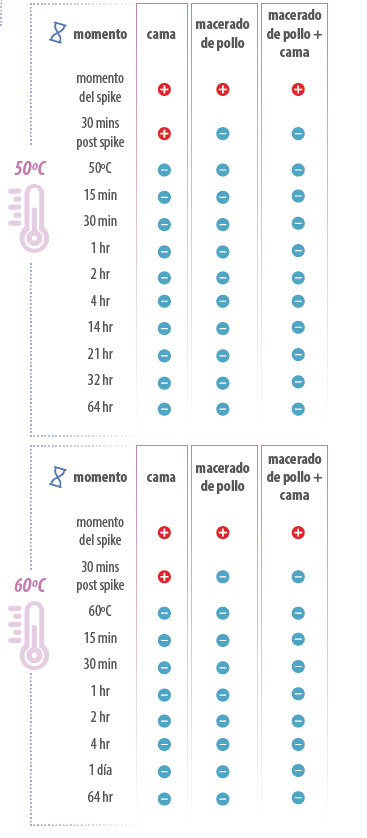
Figura 5. Detección de virus vivo en los grupos macerado de pollo, macerado de pollo + cama de broiler y cama de broiler tratados a 50 °C y 60 °C.
CONCLUSIÓN
- No fuimos capaces de detectar un efecto del uso de cama en la persistencia de IA de baja y alta patogenicidad por más de 24 y 72 horas respectivamente.
- Los acidificantes de cama son efectivos en inactivar IA de baja patogenicidad (H6N2) cuando es mezclado directamente con el virus.
- El acidificante fue capaz de inactivar el virus solo en cama de broiler y no en cama de pavo (bajo las condiciones de este experimento).
- Temperaturas de compostaje son capaces de inactivar el virus de influenza de baja patogenicidad.
- Estudios de persistencia del virus influenza como este, ayudan a tomar medidas para disminuir el riesgo de diseminación de los virus en el caso de brotes de influenza aviar de baja y alta patogenicidad.
🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en aviNews
REGISTRARME









