เนื้อหาดูได้ที่: Español (สเปน) English (อังกฤษ) Melayu (Malay) Tiếng Việt (เวียดนาม) Philipino (ฟิลิปปินส์)
โรคคลามิเดียในนก (Avian Chlamydiosis) เป็นโรคติดเชื้อที่สามารถติดต่อจากสัตว์สู่คน (Zoonotic) ซึ่งเกิดจากแบคทีเรีย Chlamydia psittaci และยังรู้จักกันในชื่อโรค Psittacosis หรือ Ornithosis โรคนี้ทำให้เกิดการติดเชื้อแบบระบบส่วนใหญ่จะมีผลต่อระบบทางเดินหายใจ และบางครั้งอาจเป็นอันตรายถึงชีวิตในนกและสัตว์เลี้ยงลูกด้วยนม รวมถึงมนุษย์ด้วย
ในฟาร์มสัตว์ปีก โรค Avian Chlamydiosis มีแนวโน้มที่จะติดเชื้อในไก่งวงมากกว่าในไก่เนื้อ ซึ่งส่งผลให้เกิดความเสียหายทางเศรษฐกิจอย่างรุนแรงในธุรกิจการเลี้ยงไก่งวงเชิงพาณิชย์

โรคที่มีลักษณะคล้ายคลึงกับ Avian Chlamydiosis ถูกบันทึกครั้งแรกในประเทศเยอรมนีในปี 1879 และมีการระบาดหลายครั้งในยุโรป โดยการระบาดที่สำคัญที่สุดเกิดขึ้นในประเทศฝรั่งเศส
ในปี 1895 ซึ่ง Morange ได้ตั้งชื่อโรคนี้ว่า psittacosis โดยใช้คำภาษากรีก Φιτταχοζ ที่ใช้เรียกนกในวงศ์ Psittacidae
- ในปี 1929 มีการรายงานเกี่ยวกับ Avian Chlamydiosis หรือ psittacosis เป็นครั้งแรก
- และในปี 1930 โรคนี้ได้แพร่กระจายไปยังหลายประเทศในยุโรป เช่น ออสเตรีย เชโกสโลวะเกีย เดนมาร์ก ฝรั่งเศส เยอรมนี เนเธอร์แลนด์ ไอซ์แลนด์ อิตาลี นอร์เวย์ โปแลนด์ สเปน สวิตเซอร์แลนด์ และสวีเดน รวมถึงอัลจีเรียและอียิปต์ในแอฟริกาเหนือ เม็กซิโก แคนาดา และสหรัฐอเมริกาในอเมริกาเหนือ และญี่ปุ่นและออสเตรเลียในแปซิฟิกตะวันตก
ระหว่างปี 1988 ถึง 1998 ศูนย์ควบคุมและป้องกันโรคของสหรัฐอเมริกา (CDC) ได้รับรายงานเกี่ยวกับ psittacosis จำนวน 813 รายการ ซึ่งถือเป็นตัวเลขที่อนุรักษ์นิยม เนื่องจากโรคนี้มีความยากในการวินิจฉัยและมักจะไม่ค่อยได้รับการรายงาน (Johnston et al., 2000)
ในช่วงทศวรรษ 1980 พบว่า ประมาณ 70% ของการติดเชื้อในมนุษย์มีสาเหตุมาจากการสัมผัสกับนกที่ถูกขังในกรง โดยเฉพาะ 43% ของกรณีเหล่านี้เกิดขึ้นกับกลุ่มคนที่เป็นเจ้าของนกเลี้ยง ผู้ที่มีความหลงใหลในนก และเจ้าของร้านขายสัตว์เลี้ยง ซึ่งถือว่าเป็นกลุ่มที่ได้รับผลกระทบมากที่สุด

นอกจากนี้ ยังมีผู้ที่อยู่ในกลุ่มเสี่ยงต่อการติดเชื้ออีกหลายกลุ่ม เช่น สัตวแพทย์ เจ้าหน้าที่ศุลกากร ช่างเทคนิคห้องปฏิบัติการ เกษตรกร และพนักงานสวนสัตว์ (Johnston et al., 2000)
จากการติดตามระบาดวิทยาในแต่ละกรณี พบว่ามนุษย์ได้มีการสัมผัสกับนกหลากหลายประเภท เช่น นกแก้วออสเตรเลีย นกแก้วทั่วไป และสัตว์ปีกอื่น ๆ
ประชากรนกที่ถูกขังในกรงเดียวกันมีความเสี่ยงสูงต่อการติดเชื้อมากกว่านกที่ถูกแยกขังในกรงต่าง ๆ นกที่ถูกกักขังในพื้นที่ปิดมีอัตราการติดเชื้อที่สูงมาก อาจสูงถึง 100% เลยทีเดียว
เอทิโอโลยี
C. psittaci เป็นสิ่งมีชีวิตชนิดพยาธิที่ต้องอาศัยเซลล์ในการดำรงชีวิต ซึ่งเป็นแบคทีเรียทรงกลมชนิดกรัมลบ ขนาดเส้นผ่านศูนย์กลาง 0.3 ถึง 1.5 μm ที่มีทั้ง DNA และ RNA ภายในเซลล์ มันมีผนังเซลล์ที่เรียบง่าย ซึ่งประกอบด้วยลิโปโพลีแซ็กคาไรด์
เชื้อสายของ C. psittaci ที่แยกจากสัตว์ปีกชนิดต่าง ๆ จะมีเซโรไทป์ที่แตกต่างกัน ซึ่งสามารถแยกแยะได้ตามโฮสต์และความสามารถในการทำให้เกิดโรค C. psittaci มีเซโรไทป์ต่าง ๆ เช่น Psittacino, Pichon I, Pichon II, Duck, และ Turkey
ปัจจุบันมีเซโรไทป์ทั้งหมด 8 ชนิด ซึ่งจะกล่าวถึงต่อไป:
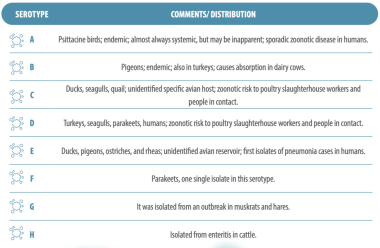
ตารางที่ 1. เซโรไทป์ต่าง ๆ ของ C. psittaci (Andersen, 1997)
การสังเกตสิ่งมีชีวิต
- สิ่งมีชีวิตสามารถสังเกตเห็นได้เป็นการรวมตัวภายในไซโตพลาซมาที่ขยายขนาดได้ที่การขยาย 800x หรือมากกว่านั้น โดยใช้กล้องจุลทรรศน์ที่มีการปรับความคมชัดเชิงเฟส (phase contrast), การมองผ่านแสงมืด (dark field), หรือกล้องจุลทรรศน์อิเล็กตรอน
- สิ่งมีชีวิตนี้มีความไวต่อสารต่าง ๆ ที่มีผลต่อเนื้อหาลิปิดในผนังเซลล์ เช่น สารประกอบแอมโมเนียมควอเทอร์นารี, แอลกอฮอล์, ไฮโดรเจนเปอร์ออกไซด์, และเงินไนเตรต
วงจรการพัฒนา
วงจรการพัฒนาของ C. psittaci ประกอบด้วย 5 ขั้นตอน:
- การยึดเกาะและการแทรกซึมของเซลล์โดย Elementary Bodies (EBs). EBs เป็นรูปแบบที่ไม่สามารถขยายพันธุ์ได้ของแบคทีเรีย ซึ่งมีขนาดประมาณ 0.3 μm
- การเปลี่ยนแปลงจาก EB ที่ไม่มีการเผาผลาญไปเป็น Reticular Bodies (RBs). RBs มีขนาดใหญ่กว่า (0.5-1.5 μm), เป็นรูปแบบที่มีการเผาผลาญ, บอบบาง และมีความหนาแน่นต่ำ
- การเจริญเติบโตและการแบ่งเซลล์แบบไบนารีของ RBs เนื่องจากการแบ่งเซลล์นี้ มิโครคอลลานีจะถูกสร้างขึ้นซึ่งประกอบด้วยเชื้อ Chlamydia ประมาณ 100 ถึง 500 ตัวต่อเซลล์
- การสร้าง RBs ที่ไม่ติดเชื้อให้เป็น EBs ที่ติดเชื้อ ขั้นตอนนี้เกี่ยวข้องกับการฟื้นฟูพื้นผิวของเยื่อหุ้มเซลล์และความเป็นพิษของมัน
- การปล่อย EBs ที่ติดเชื้อ EBs ที่ติดเชื้อจะถูกปล่อยออกมาจากเซลล์โฮสต์โดยการทำให้เซลล์แตกเนื่องจากเอนไซม์ของปรสิต
การกระจาย
โรคนี้พบได้ทั่วโลก อย่างไรก็ตาม ในเม็กซิโก เมื่อไม่กี่ปีที่แล้ว โรคนี้ถือเป็น “โรคแปลก” โดยเจ้าหน้าที่สุขภาพสัตว์ (SAGARPA)
สัตว์ที่ไวต่อโรค
นกที่ผลิตไข่, นกป่า, แพะ, แกะ, วัว, หมู, หนู, กระต่าย, และแมว เป็นสัตว์ที่ไวต่อโรคมากที่สุด รวมถึงมนุษย์

เชื้อโรค (Pathogeny)
ความเป็นโรคและความรุนแรงของ C. psittaci จะแตกต่างกันขึ้นอยู่กับสายพันธุ์ สภาพของโฮสต์, ระดับของการสัมผัส, และปัจจัยสิ่งแวดล้อม
รูปแบบการแพร่กระจายจะขึ้นอยู่กับปัจจัยดังต่อไปนี้:
- ความรุนแรงของสายพันธุ์
- ความไวของโฮสต์
การแพร่กระจายเกิดขึ้นจากการสัมผัสโดยตรงกับสัตว์ หรือผ่านทางละอองฝอย, อุจจาระ, น้ำตา, ของเหลวจากตา, และแผลต่าง ๆ โดยโฮสต์ใหม่จะติดเชื้อผ่านทางเยื่อบุระบบหายใจหรือทางเดินอาหาร
การติดเชื้อในนกอาจเป็นแบบเฉียบพลัน, กึ่งเฉียบพลัน, หรือเรื้อรังในส่วนใหญ่ของนกที่ติดเชื้อ C. psittaci จะไม่แสดงอาการของโรค
- นกที่ไม่มีอาการเหล่านี้สามารถแพร่เชื้อได้เป็นระยะ ๆ และความเสี่ยงในการแพร่เชื้อจะเพิ่มขึ้นเมื่อมีสถานการณ์เครียดเกิดขึ้น

การศึกษาบนไก่งวงได้แสดงให้เห็นว่าไมโครออร์แกนิซึมจะทำซ้ำในปอด, ถุงลม, และเยื่อหุ้มหัวใจภายใน 24 ชั่วโมง มันจะพบในกระแสเลือดภายใน 48 ชั่วโมง และสามารถแพร่เชื้อได้ภายใน 72 ชั่วโมงหลังจากการสัมผัส
อาการ (Sign)
นกเยาว์ที่สัมผัสกับสตแรนที่มีความรุนแรงมักจะพัฒนาเป็นการติดเชื้อระบบที่ร้ายแรงและทำให้ตายได้
อาการทางคลินิก (ดูภาพ 1 และ 2) ได้แก่:
- ขนยุ่ง อุณหภูมิร่างกายต่ำ การสั่นสะเทือน ซึมเซา ตาอักเสบ หายใจลำบาก การจาม โรคหวัด (ในลูกนก) ไซนัสอักเสบ (ในนกขอแคระออสเตรเลีย)
- การผอมแห้ง, การขาดน้ำ, และท้องเสียที่มีสีเขียวมะนาวหรือเทาเป็นลักษณะเฉพาะ ท้องเสียที่มีลักษณะน้ำก็อาจสังเกตเห็นได้ การตายเกิดขึ้นภายใน 8 ถึง 14 วัน การฟื้นตัวเองเกิดขึ้นได้ยาก
- โรคที่เกิดในแบบกึ่งเฉียบพลันมักพบในนกทุกชนิดที่มีความไวต่ำกว่า
- โดยมีอาการเช่น: ซึม ขนยุ่ง ตาอักเสบ คออักเสบ ตาอักเสบ (Keratitis) การมีของเหลวหรือมูกหนองจากจมูก หายใจลำบาก การสูญเสียความอยากอาหาร ปัสสาวะมาก

ภาพที่ 1 นกอเมซอน (Amazona aestiva)
อาการ: ตาอักเสบ, น้ำตาไหล (epiphora), และหายใจลำบาก
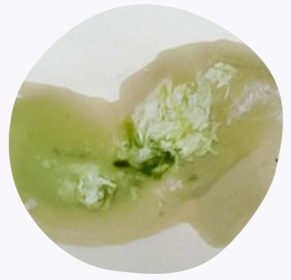
ภาพที่ 2 การพบสารบิลิเวอร์ดินูเรีย (Biliverdinuria) ในปัสสาวะ
บาดแผลทางมหภาค (Macroscopic Lesions)
ผลการชันสูตรพลิกศพ (ดูภาพที่ 3) ไม่ได้เป็นลักษณะเฉพาะของโรค แต่จะพบอาการดังนี้:
- ตาอักเสบ
- การอักเสบที่เยื่อบุช่องท้องชนิดไฟบริน (Fibrinous peritonitis)
- การอักเสบที่เยื่อหุ้อตับ (Perihepatitis)
- โรคอักเสบในลำไส้ (Enteritis)
- โรคไต (Nephrosis pneumonia)
- การอักเสบที่ถุงลม (Airsacculitis)
- ม้ามโต (Splenomegaly)
- ตับโต (Hepatomegaly)
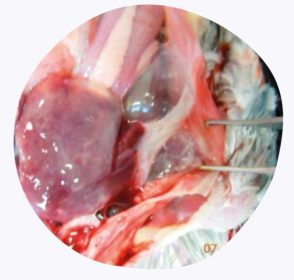
ภาพที่ 3 ผลการชันสูตรพลิกศพที่พบ ได้แก่
การอักเสบที่เยื่อหุ้อตับ (Perihepatitis)
การอักเสบที่ถุงลม (Air sacculitis)
การอักเสบที่เยื่อบุช่องท้อง (Peritonitis)
การอักเสบที่เยื่อหุ้มหัวใจ (Pericarditis)
บาดแผลทางจุลพยาธิวิทยา (Microscopic Lesions)
บาดแผลทางจุลพยาธิวิทยามักไม่เฉพาะเจาะจง ยกเว้นการพบ “อนุภาครวม” (Inclusions) ภายในเซลล์
อนุภาครวมเหล่านี้ (ดูภาพที่ 4) สามารถพบได้ในอวัยวะต่าง ๆ แต่จะพบมากในเยื่อหุ้มที่เป็นของเหลว (Serous membranes)
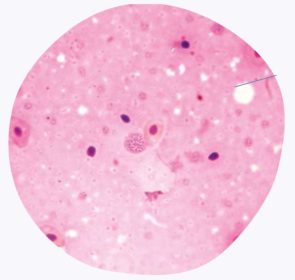
ภาพที่ 4 สามารถสังเกตเห็นอนุภาครวม (Inclusion bodies) ภายในเซลล์
การทดสอบวินิจฉัยสำหรับ C. psittaci ในสัตว์ปีก
การเพาะเลี้ยงเซลล์ (Cell Culture):
ทำโดยใช้สายเซลล์ McCoy หรือไฟโบรบลาสตของไก่หรือหนู การทดสอบนี้สามารถตรวจพบจำนวนจุลินทรีย์ในปริมาณเล็กน้อยในสองหรือสามการนับ ข้อเสียของการทดสอบนี้คือค่าใช้จ่าย, ความยากทางเทคนิค, และเวลา การนับครั้งแรกใช้เวลาหกวัน; การนับครั้งที่สองและสามใช้เวลาสามวันต่อครั้ง ดังนั้นทั้งสามการนับจะใช้เวลาประมาณสองสัปดาห์
การทดสอบด้วยเอนไซม์-ลิงค์ดิมมูโนแอบซอร์เบนท์ แอสซา (ELISA):
การทดสอบนี้ตรวจจับ Immunoglobulins IgG ในซีรั่มและแอนติบอดี IgA ที่เฉพาะเจาะจง อย่างไรก็ตาม ถึงแม้ว่าระบบนี้จะมีความไวสูงและใช้งานง่าย แต่บางครั้งก็อาจเกิดผลลบปลอมเนื่องจากผลของยากดภูมิต้านทานเช่น คลอแรมเฟนิคอล, เพนิซิลลิน, เตตระไซคลิน เป็นต้น ที่อาจได้รับการให้ยาก่อนการทดสอบ
การทดสอบด้วยการฟลูออเรสเซนซ์อิมมูนฟลูออเรสเซนซ์ทางอ้อม (Indirect Immunofluorescence Test):
เทคนิคนี้เหมาะสำหรับการแสดงแอนติเจนที่เฉพาะกลุ่ม โดยมีข้อเสียคือการฟลูออเรสเซนซ์ที่ไม่เฉพาะเจาะจงอาจเกิดขึ้นได้ ซึ่งทำให้การตีความยากขึ้น
พยาธิวิทยาฮิสโต (Histopathology):
เทคนิคนี้ช่วยในการสังเกตอนุภาครวมภายในไซโตพลาซึมเมื่อเนื้อเยื่อที่สงสัยจะถูกตัดและย้อมด้วยสารละลายของ Zenker และย้อมด้วยสารละลายของ Gimenez หรือ Macchiavelo
การทดสอบการยึดเกาะคอมพลีเมนต์ (Complement Fixation Test):
จำเป็นต้องใช้คอมพลีเมนต์ (ปกติจะเป็นหนูตะเภา) เพื่อจับแอนติเจนและแอนติบอดี ระบบนี้คล้ายกับ ELISA แต่ระบบหลังจะมีความไวสูงกว่า อย่างไรก็ตาม คอมพลีเมนต์จากหนูตะเภาเชิงพาณิชย์ไม่เหมาะสมกับสัตว์ปีกส่วนใหญ่เนื่องจากความไม่เข้ากัน
การทดสอบไมโครอิมมูโนฟลูออเรสเซนซ์ (Microimmunofluorescence, MIF) :
นี่คือการทดสอบเซอโรโลยีที่ไวที่สุดสำหรับสายพันธุ์ของคลามิดีและเป็นเพียงการทดสอบเดียวที่ตรวจจับการตอบสนองที่เฉพาะเจาะจงต่อสายพันธุ์ โดยจะมองเห็นองค์ประกอบและเรติคิวลาร์บอดี้แทนการรวมตัวของสิ่งที่สมบูรณ์ การทดสอบนี้สามารถวัดการตอบสนองของ IgM, IgA, และ IgG subclass อย่างไรก็ตามต้องการประสบการณ์และการฝึกอบรม
การทดสอบ PCR (Polymerase Chain Reaction):
ช่วยให้สามารถตรวจจับชิ้นส่วนของวัสดุทางพันธุกรรมของเชื้อโรค ได้ ปัจจุบันเทคนิคที่พบได้บ่อยที่สุดในการตรวจจับ C. psittaci คือ:
- การตรวจ PCR แบบดั้งเดิม
- PCR แบบเรียลไทม์
- ชิป DNA
การวินิจฉัยแยกโรค (Differential Diagnosis)
การวินิจฉัยแยกโรคในนกจะทำการเปรียบเทียบกับโรคต่างๆ เช่น เพสทูเรลโลซิส ซัลโมเนลโลซิส โคไลบาซิลโลซิส ไมโครพลาซโมซิส ไข้หวัดนก โรคบรูดิส (Newcastle Disease)
การรักษา (Treatment)
ในนกที่เลี้ยงในฟาร์ม การรักษาไม่คุ้มค่าทางเศรษฐกิจ สำหรับนกบ้าน การรักษาจะใช้ Doxycycline: 25-50 มก./กก. ทางปากสองครั้งต่อวัน หรือ 200-800 มก./ลิตรในน้ำดื่ม
การป้องกันและควบคุม (Prevention and Control)
การควบคุมด้านความปลอดภัยทางชีวภาพ: Cleaning and disinfection of establishments and equipment, ventilation, reduction of gas accumulation, all-in-allout handling, new and exhibited birds, quarantine for a minimum of 30 days, control of wild birds and rodents, control of mechanical vectors, use of gloves, masks, and goggles when handling suspicious birds.
การทำความสะอาดและฆ่าเชื้อสถานที่และอุปกรณ์ การระบายอากาศ การลดการสะสมของก๊าซ การจัดการตามระบบ All-in-All-out การกักกันนกใหม่และนกที่นำมาแสดงเป็นระยะเวลาไม่น้อยกว่า 30 วัน การควบคุมนกป่าและสัตว์ฟันแทะ การควบคุมพาหะทางกล การใช้ถุงมือ หน้ากาก และแว่นตาเมื่อจัดการกับนกที่สงสัยว่าเป็นโรค
- ไม่มีวัคซีนที่มีจำหน่ายในเชิงพาณิชย์ มีเพียงการทดลองฉีดวัคซีนบางชนิดในไก่งวง ซึ่งให้ผลลัพธ์ที่ผสมผสานกัน
ความสำคัญในอุตสาหกรรมสัตว์ปีก
ความสำคัญทางเศรษฐกิจในอุตสาหกรรมสัตว์ปีกมาจากประสิทธิภาพการผลิตที่ต่ำของไก่รวมถึง:
- การเจริญเติบโตช้า
- การสูญเสียไขมัน
- อาการซึมเศร้า
- การหยุดการวางไข่
- ในไก่งวง การผลิตไข่อาจลดลงได้ถึง 60%
เนื่องจากเชื้อก่อโรคเป็นแบคทีเรีย การสร้างภูมิคุ้มกันที่สมบูรณ์หลังจากการเกิดโรคจึงเป็นเรื่องที่ยาก ภัยเสี่ยงจากการติดเชื้อซ้ำยังไม่ทราบแน่ชัด
สรุป
การตรวจจับ Chlamydia psittaci จากตัวอย่างไก่อย่างสม่ำเสมอเป็นสิ่งสำคัญในการควบคุมการติดเชื้อในฟาร์มสัตว์ปีก และเพื่อดำเนินมาตรการป้องกันและแคมเปญที่มุ่งหวังในการให้ข้อมูลแก่ประชาชนที่อาจได้รับผลกระทบจากโรคนี้

เยี่ยมชมt ที่นี่
*เอกสารอ้างอิงสามารถขอได้ตามคำขอ
เรื่องที่คุณอาจสนใจ:
S. Infantis: an emerging serotype that became resident? Part II
Rearing: “The right beginning” for an excellent egg production
Most frequent respiratory infections in turkeys
[/ลงทะเบียน]
🔒 เนื้อหาเฉพาะสำหรับผู้ใช้ที่ลงทะเบียน.
ลงทะเบียนฟรีเพื่อเข้าถึงโพสต์นี้และเนื้อหาเฉพาะทางอื่น ๆ อีกมากมาย ใช้เวลาเพียงหนึ่งนาทีและคุณจะสามารถเข้าถึงได้ทันที
เข้าสู่ระบบลงทะเบียนได้ที่ aviNews
ลงทะเบียน