
Salud Animal
Importancia de una correcta vacunación en el control de la bronquitis infecciosa
Para leer más contenidos de aviNews España Diciembre 2024
Salud Animal
Para leer más contenidos de aviNews España Diciembre 2024
La Bronquitis Infecciosa (IB) es una de las enfermedades contagiosas del sector avícola más relevantes desde el punto de vista económico.
Los principales retos en su control radican en la notable variabilidad del virus, y la heterogeneidad de las cepas locales, reflejándose en su variable epidemiología y diferentes estrategias de control. La utilización de vacunas eficaces son una herramienta fundamental en este marco, ya que previenen la susceptibilidad de los animales a las infecciones y sus consecuencias.
En los últimos años, muchos estudios han destacado como la asociación de vacunas de tipo Massachusetts con vacunas del tipo 793B confieren la protección heteróloga más amplia frente a las cepas más extendidas en Europa, como QX y la variante 2, siendo este protocolo vacunal el más utilizado habitualmente.
SEGUIMIENTO EN LA SALA DE INCUBACIÓN:
Por todo ello, la auditoría externa de los procedimientos de vacunación de manera periódica en las incubadoras se antoja vital para intentar lograr el mayor porcentaje de aves correctamente vacunadas. En estas visitas periódicas, el equipo de CEVA con su C.H.I.C.K. Program realiza una aproximación en varios niveles:
Vacunación en SPRAY:
El mayor porcentaje de aves vacunadas frente a IBV en incubadoras es vía spray. La calidad de vacunación por spray va a depender de ciertas variables, siendo el tipo de máquina empleada un factor muy importante.

Gotas uniformes del tamaño correcto
El tamaño de gota recomendado para vacunar pollitos de un día está sobre 150-200 μm. El tamaño de la gota viene definido por el tipo de boquilla y la presión del aire. Sin embargo, el tamaño inicial de la gota varía mucho respecto al del lugar del impacto, ya que el diámetro de la gota disminuye mucho por evaporación desde la boquilla hasta los pollitos. El objetivo es alcanzar al llegar al pollito valores de gota de 3-5 μm. Tamaños de gota más pequeños aumentan el riesgo de reacción posvacunal por penetrar demasiado en el tracto respiratorio, y tamaños de gota más grandes podrían no llegar al órgano diana.
Por ello, una de las cosas más importantes es que el tamaño de gota debe de ser uniforme en toda la superficie de aplicación, evitando tener disparidad de tamaños de gota llegando a las aves (Figura 5 y 6).

Distribución de los pollitos en las cajas:
El funcionamiento de ciertos automatismos actuales de las salas de incubación pueden impactar en la distribución de los pollitos de un día dentro de la caja al aplicarles el spray. Por ejemplo, paradas bruscas en la cinta automática transportadora. La desigual distribución de los pollitos en la caja podría causar el desperdicio de la vacuna (vacuna en áreas sin pollitos) y que algunas aves reciban menos vacuna de la necesaria. Esto se puede solventar mediante el uso de spray automático en línea.
Voluntad constante:
Limpieza y mantenimiento del equipo:
Este es un punto clave a tener en cuenta y suele aparecer como causa frecuente de problemas de aplicación.
Vacunación en gel:
Otra metodología realizada recientemente es la aplicación de vacuna de IBV mediante gel. Este enfoque podría ser ventajoso porque el gel podría limitar la excesiva humedad de las plumas, que podría afectar negativamente a la temperatura de los pollitos, ayudando al ave a hidratarse, así como poder ser utilizado como vehiculador de probióticos, vitaminas.
Recientemente, varios estudios nos demuestran la eficaz inmunización de aves mediante gel con vacunas frente a IB testadas en este medio, así como su cinética en las aves respecto a la aplicación tradicional por spray. A su vez, este tipo de vacunación nos permite evaluar la calidad de aplicación en la misma sala mediante la inspección de lenguas (Figura 7).
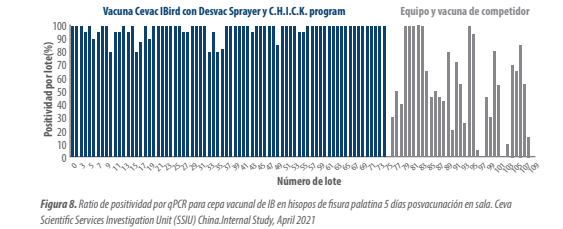
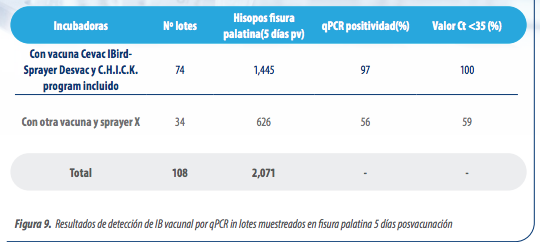
Como hemos comentado antes en la vacunación por spray, la preparación por los operarios, las características de la máquina de aplicación para generar la cobertura y tamaño de gota adecuado, así como su mantenimiento y limpieza, y las propiedades del gel y dosis utilizado para obtener una gota consistente, nos marcarán el éxito del proceso (Figura 8 y 9).

SEGUIMIENTO EN CAMPO:
Además de los métodos empleados en la sala para evaluar la correcta aplicación de las vacunas, en campo podemos confirmar que las aves recibieron la vacuna mediante su detección, indicando su correcta replicación, y por tanto la inmunización. Para ello, métodos moleculares como las real time RT-PCR específicas que nos proporcionan algunas vacunas nos permiten detectar su presencia en las aves, así como información de la carga vírica de la misma, de un manera sencilla y rápida.
Un muestreo de varias naves de diferentes días de vacunación en sala nos permite saber en qué valores estamos y si son los adecuados, siendo aconsejado estar por encima del 90% de positividad en las aves muestreadas. Además, el valor Ct (cycle threshold value) obtenido en la real time RT-PCR nos dará información de la cantidad de virus vacunal que encontramos en las muestras, siendo valores bajos de Ct indicativos de mayor carga de virus vacunal.
Estudio:
Como ejemplo de este tipo de seguimiento, Ceva realizó en China un estudio interno para comparar la eficacia de la vacunación con diferentes vacunas de IB, equipos de spray y servicios de incubadora (International Hatchery Practice . Volume 35 Number 4).
Los lotes vacunados con Cevac IBird®/spray Desvac (incluyendo auditorías C.H.I.C.K. Program) mostraron un 97% de positividad por RT-qPCR y el 100% de ellos obtuvieron valores medios de Ct inferiores a 35, frente al 56% de positividad por RT-qPCR y 59% de valores Ct superiores a 35 para la vacuna y equipo competidor (Figura 8 y 9).
Estudio:
En otro estudio interno realizado en España durante el último año, se tomaron muestras de 21 naves vacunadas mediante gel (Cevagel®) en incubadora con las vacunas Cevac IBird® y Cevac MassL®, lo que supuso un un total de 480000 aves incluidas en el estudio.
CONCLUSIONES:
Una correcta vacunación es clave para el control de la IB. Para ello, las auditorías de vacunación en sala y el chequeo posterior en las aves para demostrar que la vacuna está replicándose se han demostrado vitales para poder comprobar que las aves están adecuadamente inmunizadas y evitar las consecuencias de la ausencia de protección.