
El virus de la bronquitis infecciosa (IBV) de las aves es en la actualidad una de las principales enfermedades asociadas al síndrome respiratorio en las aves domésticas, así como a las pérdidas relacionadas con la producción de carne y huevos.
El agente etiológico, es el virus de la bronquitis infecciosa aviar (IBV):
Especie, Coronavirus aviar,
Orden, Nidovirales
Sub orden, Cornidovirineae
Familia Coronaviridae
Sub familia, Orthocoronavirinae
Género, Gammacoronavirus
Sub género, Igacovirus.
El genoma viral tiene una longitud de aproximadamente 27 kb (27,000 pares de bases) y codifica proteínas no estructurales (como la ARN polimerasa dependiente de ARN y otras proteínas reguladoras y accesorias) y estructurales (es decir, la espiga, la envoltura, la membrana y la nucleocápside).
La proteína espiga (S), y la subunidad S1 en particular, juegan un papel importante en el tropismo celular, la unión al receptor celular que contiene acido cialico, los anticuerpos neutralizantes y la inducción de la respuesta inmune mediada por células.
Además, la alta variabilidad genética del gen S1 ha impulsado su uso para la clasificación de cepas de IBV en genotipos y linajes, que pueden mostrar una distribución geográfica significativamente diferente y, en el comportamiento biológico y características inmunológicas. Se ha sugerido que la entrada del IBV en las células depende de las moléculas lipídicas y del pH bajo.

De hecho, los virus de ARN mono catenario de sentido positivo, el IBV puede evolucionar rápidamente y recombinarse lo que lleva a la aparición de una notable variabilidad genética y fenotípica a lo largo del tiempo.
Esta heterogeneidad plantea desafíos notables para la comprensión de la epidemiología de IBV y su control.
Actualmente, la vacunación representa la estrategia más aplicada y eficaz para limitar el impacto de la enfermedad.
Sin embargo, la variabilidad antigénica conlleva a la existencia de varios serotipos y proteotipos, lo que se traduce en una escasa protección cruzada entre genotipos, requiriendo el uso de autovacunas o vacunas homologas.
La recombinación en la familia Coronaviridae ha sido bien documentado y es un factor que contribuye a la aparición y evolución de diferentes serotipos y genotipos de coronavirus. La diversidad genética de los coronavirus se debe a la evolución adaptativa impulsada por altas tasas de mutación y recombinación genética.
Las altas tasas de mutación se atribuyen a las capacidades mínimas de corrección de pruebas asociadas con la polimerasa.
Se cree que la recombinación se debe a un mecanismo único de “elección de copia” de cambio de plantilla durante la replicación del ARN.
Se ha observado evidencia de recombinación entre cepas de IBV tanto experimentalmente como en el campo.
Desafortunadamente, incluso las autovacunas estrechamente relacionadas con el serotipo y proteo tipo con el tiempo pueden caer en episodios de protección incompleta o de escape inmune de la vacuna debido a la sustitución de aminoácidos en sitios antigénicos específicos de la proteína S1.
Cuando la inmunidad no evita la eliminación total del virus de IBV, las cepas silvestres pueden circular en un entorno nuevo y más desafiante, adaptándose potencialmente a él.
Se pueden mencionar numerosos ejemplos de virus que, en diferentes grados, eludieron las estrategias de vacunación por inmune-escape como el virus de la hepatitis aviar, metapneumovirus aviar, circovirus porcino; aumento de la virulencia como los virus de la enfermedad de Marek y de GUMBORO.
La inmunidad a la vacuna contra el IBV no elimina totalmente al virus y es posible una cierta persistencia viral en los animales vacunados.

El escenario empeora aún más por la cobertura típicamente parcial lograda por los protocolos de vacunación de rutina en condiciones de campo que, aunque suelen ser eficaces para prevenir brotes clínicos y reducir la presión infecciosa, facilitan la circulación de virus de campo en una población parcialmente inmunizada.
Muchos estudios basados en un enfoque filo dinámico, realizado en la misma área geográfica y período de tiempo, demostraron los beneficios de la introducción de las vacunas homólogas o autovacunas para reducir el tamaño de la población viral y la frecuencia de los brotes.
Debido a la gran versatilidad de los coronavirus para infectar diferentes tejidos, las poblaciones de linfocitos T CD4 y CD8 pueden verse afectadas en algunos modelos de infección, lo que interfiere con la eliminación del virus, ya que afecta las respuestas adaptativas de las aves.
Tanto las respuestas humorales como las mediadas por células son importantes en el control de las infecciones, y actualmente cualquier desafío de campo que cause inmunosupresión predispone a las aves a la bronquitis infecciosa u otros síndromes respiratorios.
La inmunidad innata es crucial para el control de las infecciones de campo de IBV, y su activación temprana se basa principalmente en la acción del Interferón-gamma, como resultado de la acción de los macrófagos, además de otras sustancias, durante el proceso inflamatorio temprano.
Una gran cantidad de factores innatos están involucrados en el reconocimiento temprano del virus, como el TLR-3 en los macrófagos.
De manera similar, se han reconocido otras citocinas en respuesta a diferentes infecciones virales respiratorias causadas por virus de ARN.
Estas citocinas están involucradas sinérgicamente en la detección de la presencia del virus, desencadenando una cascada de otros factores, que dan como resultado no solo la protección innata de las células adyacentes, sino que también facilitan la activación y migración de los linfocitos T a los sitios de desafío.
Estas respuestas adaptativas de las aves contra el virus son la base del desarrollo de respuestas inmunes humorales y mediadas por células.
Estas respuestas son esenciales, ya que la presencia de títulos elevados de anticuerpos sistémicos se correlaciona con la falla en la detección de virus en los riñones y en el ovario y oviducto, así como con la ausencia de disminución de la producción o calidad de los huevos.
Durante la infección natural, las respuestas inmunitarias están equilibradas, pero, después de la vacunación, factores como la cepa de la vacuna (HOMOLOGIA), la edad del ave y la expresión de MHC-I y MHC-II, así como la proporción de CD4 a CD8, pueden variar, ejerciendo una mayor presión de selección sobre el virus.
Al igual que ocurre con otros virus de ARN, la respuesta inmune inducida por la infección, y especialmente por el uso de vacunas, ejerce una presión de selección que permite que el virus se adapte al huésped y al medio ambiente a lo largo del tiempo aumente su capacidad de mutar.
La ausencia de un mecanismo de corrección en la replicación del virus es uno de los factores predisponentes y determinantes de la tasa de mutación observada de aproximadamente 10-3, que es similar a la mutación del virus de la influenza.
La tasa de mutación del IBV se estableció en 1,5% – 2,5% por año en presencia de vacunación y como 0,3% sin vacunación.
El desarrollo de futuras vacunas contra la bronquitis infecciosa debe tener en cuenta estudios que evalúen la capacidad neutralizante de los anticuerpos anti-proteína S2 ya que, a pesar de ser menos efectivos que los S1, el genoma conservado de la proteína S2 es importante es aquí donde juegan un rol importante las vacuna homologas o autovacunas.
En este contexto, se debe evaluar el uso correcto de herramientas para evitar la infección por IBV y se deben considerar todos los factores, desde brindar buenas condiciones ambientales (incluida la densidad de aves, lotes de una sola edad, bioseguridad, etc.) hasta comprender cómo y cuándo estimular el sistema inmunológico para brindar protección contra la enfermedad.
La capacidad de las aves para responder a un desafío a cualquier edad depende del correcto desarrollo del sistema inmunológico, desde la vida embrionaria hasta la madurez, alrededor de las 3 a 6 semanas de edad.
La presencia de anticuerpos o células T citotóxicas que reaccionan específicamente al antígeno depende de la calidad de la bolsa de Fabricio y el timo del ave hasta la madurez sexual.
Cualquier factor que afecte a estos órganos durante su desarrollo resultará en un mayor costo metabólico debido a la cascada de respuesta inmune, afectando consecuentemente el resto de la vida del ave.
Al sexto día de vida embrionaria, el timo comienza a ser colonizado por células indiferenciadas que se convertirán en linfocitos T, alcanzando un pico en 15 o 16 días.
Después del décimo día de vida embrionaria, la bolsa comienza a colonizarse. En el momento del nacimiento, estos órganos se desarrollan anatómicamente, pero los estímulos externos aceleran la maduración funcional.
Como los desafíos ambientales son muy diferentes, la presencia de anticuerpos maternos en los pollitos recién nacidos garantiza una respuesta a los desafíos externos presentes durante las primeras etapas de la vida.
La importancia de esa protección pasiva es diferente según la enfermedad, pero los anticuerpos IgG (IgY), transmitidos de la gallina al pollito a través de la yema, generalmente se pueden detectar en el suero y en la mucosa respiratoria de los pollitos.
Diferentes estudios han demostrado que los anticuerpos maternos pueden controlar las infecciones durante un período inicial que varía de 7 a 14 días, según el método de determinación de anticuerpos (ELISA), el tipo de infección y el virus causal (SEROTIPO).
El control de las infecciones virales en los sitios de entrada al cuerpo está muy influenciado por la respuesta local adaptativa e innata después de la inmunización.
El papel clásico de la vacunación mucosal, que consiste en estimular la producción de IgA, sigue siendo controvertido cuando se estudia el modelo de bronquitis infecciosa.
Muchas pruebas post-infección primarias y secundarias, incluida la caracterización de la inmunidad de memoria frente al IBV, han mostrado niveles elevados de IgY local.
Así mismo demostraron que la presencia de IgA es importante para controlar la infección y que las células plasmáticas de larga vida, como las que se encuentran en la médula ósea de los mamíferos, se observan en el bazo de las aves.
Los niveles de IgY pueden estar presentes durante al menos 18 semanas, lo que garantiza una reacción rápida cuando surge un desafío.
La vacunación de pollitos de un día de edad puede ser ineficaz, pero puede ser una medida importante para un primer desafío controlado inducido por la vacuna.
De manera similar, la acción de la respuesta local mediada por células en la infección principal parece acelerar claramente la eliminación viral, pero su importancia es mínima cuando no son anticuerpos homólogos.

Las células T citotóxicas se detectan 3 días después de la infección por IBV y alcanzan su punto máximo en 10 días.
Durante ese período, la infección normalmente se resuelve y el virus se elimina. Después de eso, el número de CTL (linfocitos T citotóxicos) disminuye, junto con los títulos de virus en el sistema respiratorio y en los riñones.
Dos semanas después de la infección, la cantidad de células no es suficiente para proteger al ave. Esto puede explicarse por el alto costo metabólico de esa respuesta, que se reduce al no ser necesaria.
Los protocolos de vacunación actuales apuntan principalmente a aprovechar la situación de manejo, ya que los pollitos de un día salen de la incubadora ya vacunados, y al hecho de que, en el momento del desafío, los pollitos están protegidos por la IgY maternal, además de la respuesta celular innata.
La presencia de un virus vacunal atenuado en el sistema respiratorio tiene como objetivo prevenir su colonización por virus salvajes.
A esto se le denomina inmunoexclusión y, como se mencionó anteriormente en el caso del IBV, puede haber consecuencias indeseables en el tiempo, no solo por la presión de selección, sino también por reversión y mutación del virus vacunal, que puede convertirse en variable incontrolable en el mediano plazo.
La pregunta de cuánto tiempo dura esta protección activa después de una dosis de vacuna viva al día de edad no tiene una respuesta simple, porque involucra
la intensidad del desafío,
uniformidad de la parvada,
presencia de anticuerpos maternos,
homología de la cepa vacunal,
estado fisiológico de las aves etc. y
la inmunidad innata (local y sistémica) y de
la inmunidad mediada por células en la eliminación del virus después de la infección primaria.
Los anticuerpos neutralizantes inducidos durante la bronquitis infecciosa se dirigen contra la proteína S1 del pico de la superficie.
Después de la infección (pi), la IgM alcanza su punto máximo en 12 días y disminuye hasta el día 20 pi. La presencia de IgY no se detecta normalmente hasta el día 10 pi, pero aumenta exponencialmente entre los días 20 y 30 pi.
La inducción de linfocitos T citotóxicos por los linfocitos T CD8 son muy importantes en las primeras etapas de la infección.
Esas células se detectan durante un período prolongado a niveles decrecientes, como resultado de una disminución en la exposición.
La inmunidad protectora contra la bronquitis infecciosa es compleja y no es el resultado solo de la sensibilización del ave con la proteína espiga específica o de interacciones de anticuerpos específicos en un desafío futuro.
Además de las características individuales de las aves, que determinan su capacidad de respuesta, otras proteínas que no son epítopos importantes, pero que pueden sufrir combinaciones, determinando de esta manera diferente patogenicidad, influyen en la capacidad de respuesta de las aves.
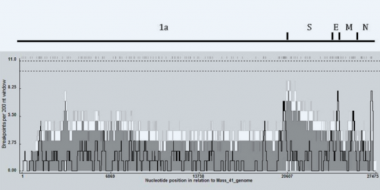
Gráfico de distribución de puntos de corte de recombinación generado para IBV usando el Programa de Detección de Recombinación 4 (RDP4) que muestra los puntos de corte de recombinación detectables.
En el presente grafico, se obtuvo evidencia de que se está produciendo recombinación entre los aislados de IBV de coronavirus aviar en todo su genoma.
Cada secuencia incluida en el análisis fue reconocida como un receptor potencial de secuencias adquiridas horizontalmente en algún momento de su pasado evolutivo viral.
Los puntos de corte en el gen de la poliproteína tienen el potencial de alterar la patogenicidad del virus, y los puntos de corte cercanos o en pico tienen el potencial de conducir a la aparición de nuevos serotipos de IBV o nuevos coronavirus.
Aunque la región de la espiga determina el serotipo del virus, el resto del genoma puede ser un mosaico de fragmentos de secuencia de una variedad de gamma-coronavirus.
La única evidencia de un coronavirus gamma que posiblemente se recombina con un coronavirus alfa o beta fue el descubrimiento de la naturaleza en mosaico del genoma del coronavirus del SARS.
Aunque este tipo de recombinación es posible, parece ser de naturaleza poco común. Así mismo la recombinación en IBV es más extensa de lo que se pensaba anteriormente, involucrando regiones de todo el genoma.
Nuestros datos sugieren que la evolución reticulada debido a una alta frecuencia de recombinación en el IBV probablemente juega un papel importante en la generación de nuevos serotipos del virus.

La caracterización, distribución y frecuencia de los puntos de corte de la recombinación son informaciones importantes para la comprensión de los mecanismos detrás de la diversidad y evolución de estos virus para poder desarrollar mejores métodos de control y vacunación.
Lo que queda claro es que la introducción de vacunas con baja homología en las granjas lo único que ocasionan es aumentar la presión genética para que aparezcan nuevos serotipos.


Materias Primas
Suscribete ahora a la revista técnica de avicultura
AUTORES

Importancia en la avicultura familiar y de traspatio de la Enfermedad de Marek y la Leucosis Linfoide – Parte I
Dra. Norma Calderón MVZ. Leopoldo Paasch
ÁCIDO HIPOCLOROSO: ¡Una nueva era en la potabilización del agua!
Jose Luis Valls
¿Vale la pena instalar un panel evaporativo adicional en un galpón de pollos de engorde?
Brian Fairchild Mike Czarick
Innovación: Conceptos y estrategias complementarias para incrementar aún más el consumo de carne de pollo
Eduardo Cervantes López
Incubación Unietápica Vs. Incubación Multietápica : Competencias y oportunidades
Dr. Marco Antonio Juárez Estrada
Soluciones potenciales para el síndrome del hígado graso hemorrágico en gallinas ponedoras
Edgar O. Oviedo-Rondón
Gestión integral de la producción de pollo de engorde: Contribuyendo a la rentabilidad de la empresa. Parte III
Ing. Jorge Robles
Cobb-Vantress fortalece su presencia en América Latina con una serie de encuentros técnicos enfocados en el aumento del rendimiento productivo
Equipo Técnico Cobb-Vantress
Optimizando el desempeño en situaciones de estrés
Felipe Horta MV MSc - Director de producto del Grupo Nuproxa
Manejo de Incubación: estrategias para garantizar la calidad del pollito de un día
Equipo Técnico Aviagen
Datos para un procesamiento avícola más inteligente: Impulsar la eficiencia y mejorar la calidad del producto
Equipo Técnico BAADER
Aumente el rendimiento de su planta de incubación con el nuevo servicio de asistencia a la incubación basado en datos de Petersime
Equipo Técnico Petersime