Aunque el primer reporte de la Laringotraqueitis infecciosa de las aves (LTI) haya ocurrido hace casi 100 años (1925), la enfermedad continúa siendo considerada una de las más importantes de la avicultura industrial debido a los frecuentes brotes que conllevan a elevadas pérdidas productivas y económicas.
La LTI fue la primera enfermedad de las aves de origen viral para la cual fue creada una vacuna (1932).
Actualmente vacunas vivas atenuadas creadas en las décadas de los 60 y 70 continúan siendo usadas en algunos países. Sin embargo, existe una clara tendencia de prohibir el uso de este tipo de vacunas por los serios problemas de seguridad asociados a su uso.




ASPECTOS ETIOLÓGICOS

AGENTE VIRAL
El agente causante de la LTI es el Gallid herpesvirus tipo 1 (GaHV-1), miembro del género Iltovirus, de la familia Herpesviridae.

Por ser virus DNA, el VLTI tiene genoma estable, presentando baja variabilidad genética entre diferentes virus aislados de diferentes regiones del mundo. De esta forma, análisis moleculares sofisticados son necesarios para diferenciar entre:
a) virus vacunales y de campo;
b) virus vacunales y
c) virus de campo.
Virus de campo y vacunales presentan alta homología antigénica mostrando que todos pertenecen al mismo serotipo.


Aunque el VLTI puede ser inactivado por varios agentes químicos, presenta alta termoestabilidade relativa: mantiene su infectividad por varios meses en medios líquidos a temperatura de 4oC.
El VLTI puede permanecer viable por varias semanas en la cama, excrementos y carcasas.



Si bien el VLTI presenta envoltura, el virus es resistente a varios desinfectantes comerciales utilizados en la industria avícola en la presencia de materia orgánica. Sin embargo, se muestra sensible al cloroformo, éter, creso 3%, fenol 5%, hipocloritos e iodóforos.


Diferentes estudios mostraron que la virulencia varía considerablemente, resultando en infecciones que van de subclínicas o asintomáticas hasta una enfermedad respiratoria severa con alta morbilidad y mortalidad.
Es bien documentado el potencial del VLTI de baja virulencia de transformarse en virus de alta virulencia, capaz de producir enfermedad clínica. Estudios experimentales mostraron que virus de bajavirulencia (tanto virus de campo así como originados de vacunas vivas) aumentan su virulencia después de varios pasajes ave-ave.

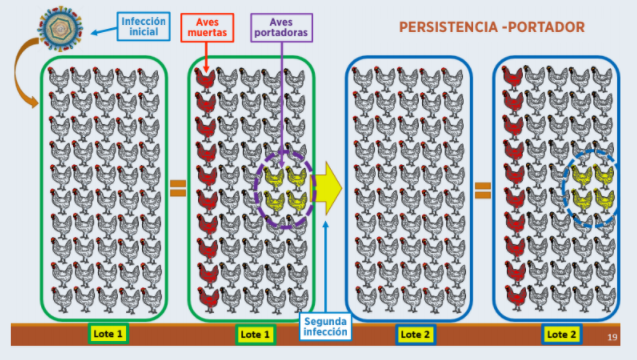
Monitorias serológicas de campo detectaron circulación viral en granjas sin evidencias de signos clínicos, y luego de un espacio de tiempo variable, las granjas presentaron la forma clínica de la enfermedad.



El estado de portador é caracterizado por períodos de latencia intercalados con cortos, intermitentes y espontáneos episodios de diseminación viral. El virus puede ser encontrado 4 a 7 días después de la infección en el ganglio trigeminal, principal local de latencia viral, y puede permanecer allí por hasta 15 meses.



La expresión del DNA viral latente es promovida por factores estresantes y/o alteraciones hormonales, como el inicio de la producción de huevos, transferencia de jaulas o muda forzada.
El VLTI reactivado del estado latente, sea de campo o acunal, tiene la capacidad de causar enfermedad con el mismo grado de intensidad que la causada por el virus aislado de casos de infección aguda.
Gráfico 1. Perpetuación del VLTI a través de infecciones latentes en aves portadoras.
ASPECTOS EPIDEMIOLÓGICOS
TRANSMISIÓN
El VLTI puede ser transmitido por contacto directo de ave infectada con ave susceptible, y de forma indirecta a través del contacto con materiales contaminados.


Otras fuentes de transmisión implicadas en brotes incluyen aves con infecciones latentes, materiales de cama, equipos y fómites contaminados.

Diversas publicaciones
mostraron que el
transporte de aves
infectadas y estiércol
contaminado son las
principales vías de
contaminación.
Un estudio caso-control, identificó que granjas localizadas en el flujo de corrientes de vientos comunes
Otros factores de riesgo importantes son:



HOSPEDEIROS
Pollos y gallinas comerciales de todas las edades son susceptibles. En la actualidad es posible observar una enfermedad clínica severa en granjas de pollos de carne y ponedoras comerciales desde los 35 días de edad. En granjas de múltiples edades, la presentación más precoz de la enfermedad de muestra un nivel de contaminación elevado en la granja.
Otras especies afectadas son los faisanes, pavos, gallina de Guinea, patos y aves de traspatio, todos ellos reservatorios y potenciales fuentes de infección para granjas comerciales.

Fotos 1. Pollos, ponedoras y reproductoras presentando la forma severa de la LTI

ASPECTOS PATOGÊNICOS

El VLTI se multiplica principalmente en el epitelio de la laringe y tráquea, y en otras membranas y tejidos como conjuntiva, senos nasales, sacos aéreos y pulmones. El virus está presente en la tráquea y en la secreción traqueal por 6 a 8 días pós-infección (PI).

La forma y la severidad de la enfermedad dependerá de vários fatores que incluyen:


línea genética y edad del ave;

nivel de resistencia y estatus de inmunidad

infecciones concomitantes y condiciones ambientais.
Para fines prácticos son reconocidas tres formas:
Severa
Los signos clínicos incluyen:






Las aves que contienen altas cantidades de exsudados caseosos con disnea producen estertores. El ave extiende el cuello en la tentativa de inhalar aire y material sanguinolento puede ser observado en el pico, plumas, cama, paredes y jaulas. La tasa de morbilidad es alta (100%) y la mortalidad puede llegar hasta 70%, aunque se sitúan entre 10 e 40%.
Leve
Pueden ser observados signos inespecíficos como traqueítis mucoide leve, sinusitis, conjuntivitis con secreción, morbilidad variable y baja mortalidad (<2%). En caso de pollos, la conversión alimenticia y ganancia de peso serán afectados.
Asintomática
Presencia de virus de baja virulencia y ausencia de cualquier signo clínico.
Fotos 2. Formas clínicas de la enfermedad

Laringotraqueítis
Virus de alta virulencia
Lote sin inmunidad
Otros patógenos o factores involucrados
Diagnóstico fácil

Laringotraqueítis
Virus de baja virulencia
Inmunidad parcial
Sin otros agentes o factores involucrados
Diagnóstico más complicado

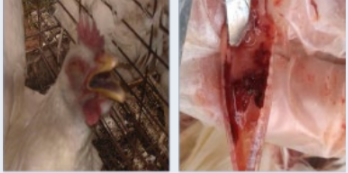
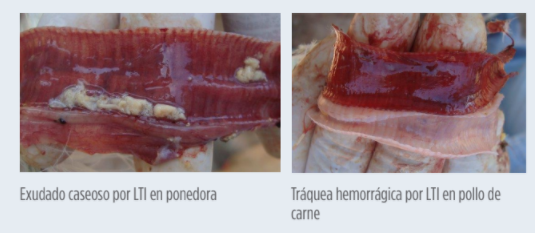
Un hallazgo común en aves infectadas por VLTI de alta virulencia es el tampón caseoso o sanguinolento en la luz traqueal.
En la tráquea, lesiones diftéricas o hemorrágicas en la mucosa, con tejido necrosado a lo largo de su mucosa
pueden ser encontradas, pudiendo extenderse hasta los bronquios, pulmones y sacos aéreos.
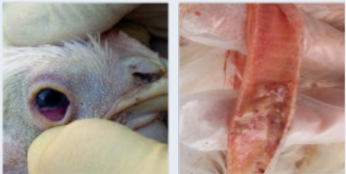
Las aves que manifiestan la forma suave de la enfermedad pueden presentar edema, inflamación y congestión del epitelio de la conjuntiva y senos infra orbitales, además de traqueítis catarral que se manifiesta de modo leve.
Fotos 3. Hallazgos macroscópicos de la forma severa de la LTI

La replicación viral en la tráquea lleva a:




Estas mudanzas causan descamación epitelial con exposición de capilares y subsecuentes hemorragias. Corpúsculos de inclusión intranucleares (CI) pueden ser visibles entre el primer y el quinto día PI, desapareciendo debido a la descamación del epitelio.
Laringotraqueíte infecciosa das galinhas (LTI)

Luego de la aparición del primer brote, la empresa/ granja afectada será económicamente impactada, pero también tendrá otros problemas de tipo logístico y comercial.
La severidad es potencializada y el control dificultado caso otros patógenos estuvieren presentes (por ejemplo, virus variante de la Bronquitis infecciosa o Mycoplasma gallisepticum).
La alta mortalidad causada (promedio de 20% del lote afectado) aumentará los costos de producción.
Durante el brote, la granja tendrá gastos adicionales debido a la desinfección sistemática durante la aparición de la mortalidad para disminución de la carga viral circulante; y medicación con antibióticos para controlar bacterias oportunistas.

Laringotraqueíte infecciosa das galinhas (LTI)

Luego del primer brote en granjas de múltiples edades, el programa vacunal y el de bioseguridad tienen que ser reforzados aumentando los gastos. El tratamiento de las heces contaminadas y de las aves muertas requiere de mayores inversiones de infraestructura y procesos, aumentando los gastos de la granja afectada.
La mortalidad aumentada imposibilitará que la granja atienda sus demandas programadas de carne (pollo), huevos (ponedoras) o pollitos (reproductoras).

DIAGNÓSTICO
El diagnóstico exacto y rápido es el primer paso para iniciar el control de la enfermedad.
En el caso de la forma severa, cuando hay expectoración de material sanguinolento, y presencia de contenido caseoso o hemorrágico en la tráquea que lleve a muerte por asfixia, el diagnóstico clínico presuntivo es de alto valor, y en la mayoría de los casos se confirma por métodos laboratoriales.
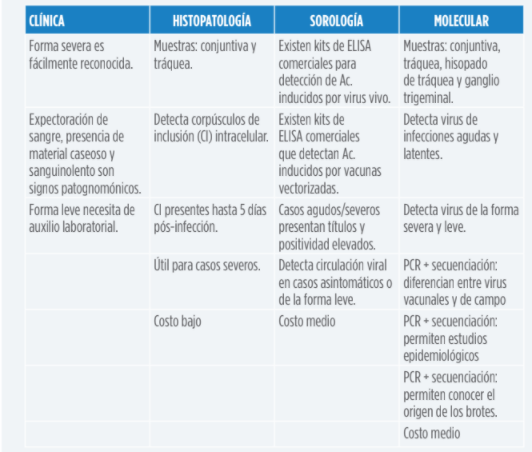
Tabla 1. Principales características de las técnicas de diagnóstico de LTI
ASPECTOS DE CONTROL

Granjas localizadas en regiones de alta densidad poblacional, con lotes de múltiples edades requieren de medidas de bioseguridad rigurosas para evitar el ingreso del agente.
Estas medidas pueden ser insuficientes cuando existen granjas vecinas presentando la forma severa de la enfermedad. La transmisión por el viento desde granjas infectadas para granjas susceptibles cuando comparten los mismos flujos de vientos predominantes muestra la limitación de las medidas de bioseguridad sin vacunación.
En la actualidad, luego de la aparición de brote severo, las principales medidas dirigidas a evitar la propagación viral incluyen:






Una vez que la cama contaminada y la movilización de aves infectadas fueron reconocidas como las principales formas de contaminación, los esfuerzos de control deben incluir la definición de las rutas de transporte (plano de contingencia).

AGENTE INFECCIOSO

Para la eliminación del VLTI circulante en la granja es necesario limpieza y desinfección rigurosa y vacío sanitario de toda la propriedad por aproximadamente 2 meses.
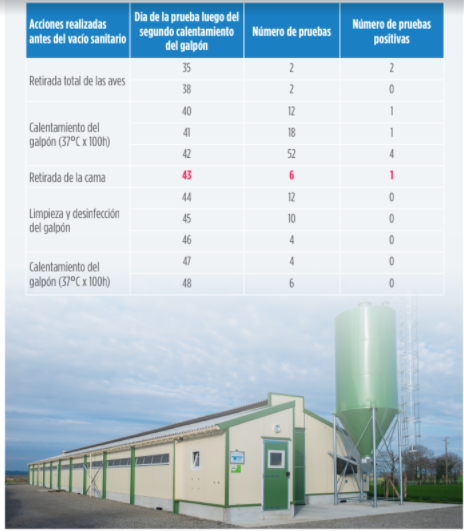
La tabla abajo muestra las principales medidas necesarias para
la eliminación del VLTI en granjas de pollos de carne luego de la retirada total de las aves de los galpones.

Tabla 2. Acciones realizadas para la eliminación del VLTI en galpones de pollos de carne infectados y tiempo necesario para la eliminación del agente infeccioso (Chin, R. et al., 2009)

Las condiciones actuales de crianza han desafiado y muchas veces quebrado intensos programas de bioseguridad. En este escenario, la inmunización de las aves de forma preventiva se revela como un fuerte aliado, creando resistencia en el lote.
En la actualidad, infelizmente, la inmunización se inicia solamente luego de la aparición del primer brote agudo.
En estos casos, el control de la enfermedad ya instalada es más trabajoso, demorado y costoso.
Particularmente em creaciones de múltiples edades, en donde el virus puede establecerse a través de aves portadoras asintomáticas que propagan el virus de forma silenciosa, el control es más difícil y demorado.

A. VACUNAS
a. Vivas atenuadas
Vacunas vivas atenuadas por pasaje en embriones de pollos (CEO) y en cultivo celular (TCO) fueron desarrolladas en la década de los 60s.
Particularmente la vacuna CEO se mostró eficaz para controlar elevadas mortalidades en casos severos de la enfermedad. Sin embargo, ellas pueden causar fuertes reacciones pós-vacunales llevando a caída de desempeño y condenaciones en granjas de pollos.
Con la disponibilidad de técnicas moleculares, se confirmó que las vacunas vivas pueden recuperar su virulencia, tornando-se agresivas a las aves y causando enfermedad.
Recientes trabajos muestran que virus de origen vacunal estaban involucrados en 65% de los brotes de la enfermedad analizados en los EUA.
b. Vectorizadas
En la actualidad existen vacunas vectorizadas para LTI que usan como vectores los virus HVT de la enfermedad de Marek (rHVT LTI) y de Viruela aviar (rFP LTI), que expresan proteínas inmunogénicas del VLTI.
Estas vacunas pueden ser aplicadas desde la planta de incubación y no tienen los problemas de seguridad de las vacunas vivas CEO e TCO por no contener virus vivo de LTI.
La frecuente detección de virus de origen vacunal en brotes en los EUA, Europa y Australia llevaron a la disminución del uso de este tipo de vacunas, observándose una clara tendencia mundial de mayor uso de vacunas vectorizadas por ser seguras.
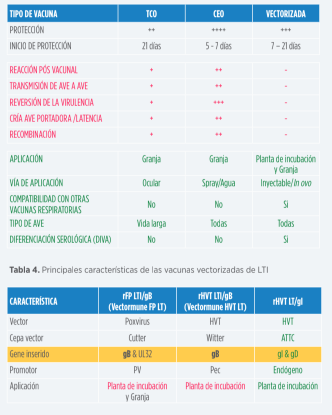
Tabla 3. Principales características de las vacunas vivas y vectorizadas de LTI


Materias Primas
Suscribete ahora a la revista técnica de avicultura
AUTORES

Importancia en la avicultura familiar y de traspatio de la Enfermedad de Marek y la Leucosis Linfoide – Parte I
Dra. Norma Calderón MVZ. Leopoldo Paasch
ÁCIDO HIPOCLOROSO: ¡Una nueva era en la potabilización del agua!
Jose Luis Valls
¿Vale la pena instalar un panel evaporativo adicional en un galpón de pollos de engorde?
Brian Fairchild Mike Czarick
Innovación: Conceptos y estrategias complementarias para incrementar aún más el consumo de carne de pollo
Eduardo Cervantes López
Incubación Unietápica Vs. Incubación Multietápica : Competencias y oportunidades
Dr. Marco Antonio Juárez Estrada
Soluciones potenciales para el síndrome del hígado graso hemorrágico en gallinas ponedoras
Edgar O. Oviedo-Rondón
Gestión integral de la producción de pollo de engorde: Contribuyendo a la rentabilidad de la empresa. Parte III
Ing. Jorge Robles
Cobb-Vantress fortalece su presencia en América Latina con una serie de encuentros técnicos enfocados en el aumento del rendimiento productivo
Equipo Técnico Cobb-Vantress
Optimizando el desempeño en situaciones de estrés
Felipe Horta MV MSc - Director de producto del Grupo Nuproxa
Manejo de Incubación: estrategias para garantizar la calidad del pollito de un día
Equipo Técnico Aviagen
Datos para un procesamiento avícola más inteligente: Impulsar la eficiencia y mejorar la calidad del producto
Equipo Técnico BAADER
Aumente el rendimiento de su planta de incubación con el nuevo servicio de asistencia a la incubación basado en datos de Petersime
Equipo Técnico Petersime