Contenido disponible en: English (Inglés)
Las metodologías de detección varían dependiendo de la especie bacteriana que se desee detectar.
- Por ejemplo, se siguen estrategias al menos un poco diferentes para la detección de S. gallinarum (SG), S. pullorum (SP) y Salmonellas móviles (entre ellas, S. enteritidis (SE), S. typhimurium (ST), S. hadar, S. heidelberg, S. virchow, S. infantis, S. kentucky y otras.
- El tipo de muestra también varía dependiendo de la especie de bacteria a detectar.
- Es mejor buscar ciertas especies de bacterias en el medio ambiente (SE por ejemplo), en las plantas de proceso (S. kentucky) o en las aves mismas (SG y SP).
SALMONELLA PULLORUM (SP) & S. GALLINARUM (SG)
Estas dos especies son específicas de especie y son microorganismos patógenos para las aves. Ambas pueden ser devastadoras para la industria avícola, de manera que la detección de estos microorganismos es crítica. El enfoque con ambos tipos de bacterias debe ser siempre la búsqueda en las aves mismas, ya sea en los reproductores o en la progenie.
Tanto SG como SP pueden causar infecciones sistémicas, de manera que las muestras para cultivo deben incluir:
- ÓRGANOS INTERNOS
- EL TRACTO REPRODUCTIVO
- EL TRACTO INTESTINAL
Es común que los órganos y tejidos que representan cada uno de estos sistemas sean agrupados para el cultivo en “pooles” de órganos por cada ave. Antes de retirar los tejidos para preparar pooles de órganos por separado se debe inocular directamente agar sangre o algún otro medio no selectivo junto con agar MacConkey (MAC) a partir de cualquier órgano que muestre lesiones macroscópicas.
Se incuban entonces los cultivos a una temperatura de 37 °C por 24 horas, observando el crecimiento bacteriano.
- Si al cabo de 24 horas no hay colonias sospechosas debe incubarse la muestra durante 24 horas adicionales antes de descartar la muestra.
- La mayoría de los protocolos para aislamiento requiere el enriquecimiento con caldo tetrationato incubado a 37°C.
SG y SP no son tan tolerantes a altas temperaturas como otras especies de salmonella. Por ello, no deben ser cultivadas a 42°C durante las primeras 24 horas antes de ser inoculadas en placas de medio de cultivo ligeramente selectivo. En contraposición, en los cultivos de Salmonellas móviles, la incubación se realiza a 42°C en estas primeras 24 horas.
Al mismo tiempo se hacen siembras directas sobre medios selectivos, como verde brillante suplementado con novobiocina (BGN). A este medio se le conoce comúnmente como BGN. Si además están buscando otras especies de salmonella como S. enteritidis (SE), en ese caso debe adicionarse cultivos en placas de agar XLT4 (Xilosa, Lisina, Tergitol).

La determinación del serogrupo es un paso crítico en la evaluación preliminar de las colonias sospechosas. Una bacteria que pertenezca al serogrupo D1 y que no sea móvil debe ser motivo de gran preocupación y debe ser identificada rápidamente utilizando pruebas bioquímicas y serológicas para confirmar o descartar la posibilidad de que se trate de SG o SP.
Existen algunos protocolos para el pre-enriquecimiento utilizando agua peptonada amortiguada (bufferada) (BPW) pero también puede utilizarse algún otro tipo de caldo no selectivo.
En nuestro laboratorio hemos hecho estudios de efectividad utilizando un aislado de SP y dos aislados derivados de aves del traspatio. En estos casos no reconocimos ninguna ventaja en la utilización del medio de enriquecimiento en caldo tetrationato
OTROS SEROTIPOS
Habrá circunstancias en las que un lote de aves pueda estar inmunodeprimido o también puede haber algún aislado de salmonela móvil que sea demasiado virulento y que esté afectando a las aves; sin embargo esto no es la norma pues muy escasas veces producirán enfermedad en aves las Salmonellas móviles, a excepción de SE, que puede causar alta mortalidad con septicemia en pollitos recién nacidos.
Con la salmonelas móviles el enfoque debe ser la preocupación por la salud pública. El propósito en este caso es monitorear y detectar salmonella de manera que puedan aplicarse medidas de intervención y otros controles para reducir los niveles de salmonella que ulteriormente podrán reducir la carga de salmonella y el riesgo para salud pública, disminuyendo así la incidencia de infecciones gastrointestinales causadas por Salmonella.
Dado que estos serotipos móviles de salmonella colonizan más frecuentemente el tracto intestinal y generalmente no causan infecciones sistémicas, por ser invasivas para el tracto intestinal tienden a ser diseminadas en el medio ambiente con facilidad.
Es factible detectar Salmonellas móviles en el medio ambiente utilizando como muestras gasas aplicadas directamente a las botas, o bien muestras de polvo de los galpones
MUESTRAS EN GRANJAS Y DE INCUBADORAS
Un buen programa de monitoreo incluye el muestreo en la granja como en la incubadora (plumón, residuo de incubación, papel de las cajas de pollitos, etc.). Estas muestras son un poco desafiantes técnicamente puesto que contienen una gran cantidad de material orgánico y muchas otras bacterias que dificultan el cultivo y detección de Salmonella. Los protocolos de aislamiento para Salmonella a partir de estos tipos de muestras se manejan bajo dos diferentes formatos.
1.-Enriquecimiento en tetrationato, seguido de enriquecimiento en MSRV (Modified Semisolid Rapapport Vassiliadis)
El método aprobado actualmente por parte del Programa Nacional de Mejoramiento Avícola (NPIP) consiste en:
- Enriquecimiento de la muestra en caldo tetrationato incubado a 37 °C durante 24 horas
- Después de esta primera incubación se transfieren 100 microlitros para inocularlos mediante punción en el centro de una placa de agar semisólido MSRV
- La placa es observada para detectar una zona de migración de bacterias a partir del punto central de inoculación
Si llega a observarse un halo de crecimiento (en el agar semisólido) alrededor del punto de inoculación entonces se inserta un asa bacteriológica en la periferia de esta zona de crecimiento para luego inocularla sobre agares BGN y XLT4 (ver Figura 2) Si por el contrario no se observa una zona de crecimiento a las 24 horas de incubación entonces la placa es incubada nuevamente durante 24 horas más también a 42 °C
d. Después de 48 horas de incubación, si acaso existe una zona de migración, se inserta un asa bacteriológica en la periferia de la zona de crecimiento en el agar MSRV para luego inocular con el asa agares BGN y XLT4
e. Estos dos agares son incubados a 37ºC durante 24 horas
f. Las placas son observadas buscando detectar colonias sospechosas de Salmonella
g. Se seleccionan entonces de tres a cinco colonias sospechosas para ser examinadas y determinar si se trata de Salmonella
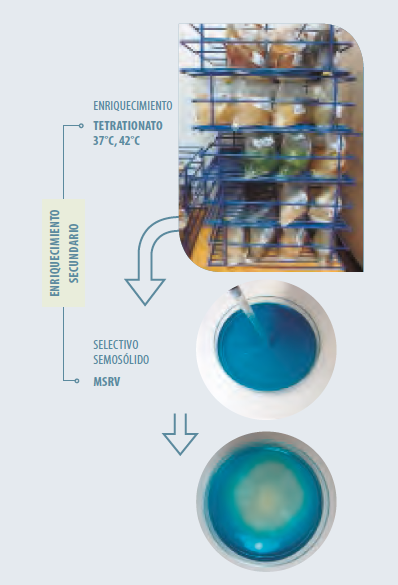
Figura 1. Cultivo de enriquecimiento en caldo tetrationato y transferencia a medio selectivo semisólido MSRV. Se inocula el agar semisólido mediante punción en el centro de la placa y se incuba el cultivo esperando que se produzca un halo de crecimiento alrededor de la zona de inoculación.
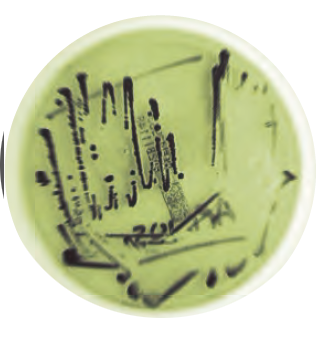
Se obtiene una muestra con un asa bacteriológica a partir del perímetro del aló de crecimiento para inocular con ella otros medios de cultivo (TSI/LIA, XLT4 y BGN), como se observa en la Figura 2.

Figura 2. Crecimiento de Salmonella en agar XLT4 (observar las colonias negras debido a la producción de H2S). Los aislados son inoculados en TSI/LIA para la confirmación de Salmonella y de ahí se inocula un medio neutro no selectivo (fotografía inferior derecha) para entonces hacer pruebas serológicas y determinar el serogrupo de Salmonella. SG, SP y SE pertenecen al serogrupo D. ST pertenece al serogrupo B.
Típicamente esto requiere la inoculación de muestras de estas colonias en medios TSI y LIA. Después de la incubación por 24 horas a 37 °C se determina si los cultivos presentan reacciones típicas o atípicas y la identidad se confirma utilizando pruebas serológicas y bioquímicas. Se pueden utilizar otras placas de agar selectivo siempre y cuando sean equivalentes a las descritas o aún mejores. Hay otras maneras de examinar los cultivos además de los medios TSI/LIA, siempre y cuando los métodos alternativos no comprometan la sensibilidad del sistema.
2.-Pre-enriquecimiento en agua peptonada, seguido de enriquecimiento en caldo tetrationato (TT), Rapapport Vassiliadis (RV) y/o en MSRV
Otro método común involucra el pre-enriquecimiento de la muestra en agua peptonada incubada a 37 °C durante 24 horas para después transferir la muestra a uno o más medios de enriquecimiento selectivos. Puede transferirse 1 ml del cultivo enriquecido hacia tetrationato (TT) y/o 100 μl transferidos a RV o MSRV. Existen varios protocolos con base en el siguiente esquema:

Investigaciones hechas en nuestro laboratorio utilizando el método de transferencia de agua peptonada a TT y RV han revelado que hay una merma en la sensibilidad con este método, mientras que el subcultivo de agua peptonada a MSRV es apenas ligeramente menos sensible que el método en el que se transfiere de TT a MSRV
MUESTREOS EN LAS PLANTAS DE PROCESO
En los Estados Unidos se utiliza actualmente un método de cultivo a partir de enjuagues de carcasas de pollo completas. Muy recientemente se ha introducido metodología que requiere la inclusión de partes de pollo molidas. El método del Departamento de Agricultura de los Estados Unidos (USDA) a través del Servicio de Inspección e Inocuidad de Alimentos (FSIS) consiste en pre-enriquecer la muestra en agua peptonada seguido de enriquecimiento en caldo TT y RV.
MUESTREOS DE HUEVOS
En los Estados Unidos la FDA ha establecido requerimientos para pollas en crecimiento y para ponedoras comerciales. El medio ambiente de los galpones debe ser muestreado a las 16 semanas y después entre las 40 y 45 semanas de edad para buscar específicamente Salmonella enteritidis
Si esta bacteria llega a detectarse deberán ser enviados al laboratorio 1000 huevos para ser sometidos a pruebas bacteriológicas con el objeto de buscar Salmonella enteritis.
Un número equivalente de huevos es muestreado cada dos semanas en cuatro ocasiones diferentes.
Si los huevos resultaran negativos durante los cuatro muestreos entonces el lote de aves vuelve a incluirse bajo la categoría de “Libre de Salmonella”.
Si alguno de los grupos de huevos resultara positivo a Salmonella enteritidis, entonces existen dos alternativas:
- El lote puede ser destruido
- Los huevos tendrán que ser redirigidos a la planta de pasteurización para venta como huevo pasteurizado en forma líquida o deshidratada, pero ya no podrán ser vendidos como huevos en cáscara
La FDA ha establecido metodologías como ésta pero también ha otorgado equivalencia a otras metodologías similares.
PDF🔒 Contenido exclusivo para usuarios registrados.
Regístrate gratis para acceder a este post y a muchos más contenidos especializados. Solo te llevará un minuto y tendrás acceso inmediato.
Iniciar sesiónRegístrate en aviNews
REGISTRARME