Etiologia
12 jun 2017
Doença de Newcastle, a mais devastadora entre as doenças da criação industrial de aves
A DN é possivelmente a mais devastadora entre as doenças da criação industrial de aves. A ocorrência de um surto de DN acarreta elevadas perdas econômicas ao país atingido.
A doença de Newcastle (DN) tem controle oficial pelo Ministério da Agricultura, Pecuária e Abastecimento (Brasil 2099 a, b), no Programa Nacional de Sanidade Avícola (PNSA). Nos estados, sob a coordenação do MAPA, os Institutos Estaduais de Agropecuária (em Minas Gerais, o IMA) são os atores do PNSA. A DN é exótica na avicultura industrial brasileira e eventuais focos devem ser erradicados, conforme as recomendações da Organização Mundial de Saúde Animal, para que o país esteja em conformidade para exportação [25].
A DN é possivelmente a mais devastadora entre as doenças da criação industrial de aves [31]. A ocorrência de um surto de DN acarreta elevadas perdas econômicas ao país atingido. Em razão deste impacto, e tendo em vista a conformidade para o comércio internacional, exigem-se aos países signatários a erradicação e a condição de livre das estirpes causadoras de doença [25]. A DN é considerada a doença de maior impacto econômico entre todas as doenças de animais, pelas despesas com erradicação, custos com enfrentamento de surtos e perdas de mercados durante a interdição [1].
A DN é causada por um vírus da família Paramyxoviridae, subfamília Paramyxovirinae [Brown et al., 1999] e gênero Avulavirus [16], classificado como paramixovirus aviário 1 (APMV- 1, Avian Paramyxovirus 1 – paramixovirus aviário 1). APMV-1 é a única etiologia da doença de Newcastle.
Há no total nove sorotipos descritos de Paramyxovirus aviários, designados APMV-1 a APMV-9. Ocasionalmente, patologias em aves domésticas foram também descritas com estirpes de vírus dos sorotipos APMV-2, APMV- 3, APMV-6, e APMV-7. Entretanto, APMV-1 é o de maior importância e ocorrência [11].
Em galinhas susceptíveis o surto de doença de Newcastle pode ser extremamente grave, 100% das aves afetadas podem morrer desde as primeiras horas de infecção e em até 72 horas sem apresentar sinais clínicos evidentes.
A DN integra a lista de doenças infecciosas de notificação obrigatória da Organização Mundial de Saúde Animal (OIE – Office Internacional des Epizooties) [25], que reúne as doenças cujas consequências socioeconômicas podem ser graves e de grande importância econômica no comércio internacional de aves e seus produtos. As suspeitas devem ser encaminhadas para diagnóstico laboratorial e são de notificação compulsória (obrigatória) em todos os países signatários e integrados à Organização Mundial do Comercio [25].
A DN é uma zoonose da classe 2, com infecção humana por quaisquer estirpes, incluindo estirpes vacinais. Entretanto, a infecção geralmente não é grave, embora possa requerer controle de infecção bacteriana oportunista. Não há relato da transmissão entre seres humanos.
A doença em humanos ocorre geralmente em funcionários de frigoríficos de aves, laboratoristas e vacinadores que aplicam a vacina com o vírus vivo e sem máscara de proteção. O período de incubação em humanos é de 24 horas e o quadro clínico consiste em conjuntivite com hiperemia, lacrimejamento, edema das pálpebras e hemorragia. Apesar de a infecção da conjuntiva poder resultar em efeitos graves, em geral a infecção é transiente e a córnea não é afetada [1]. Entretanto, há relato de um caso de infecção pulmonar grave e fatal com APMV-1 em paciente imunodeprimido [12].
A evolução das estirpes de APMV-1 ocorre a partir de mutações na região de clivagem da glicoproteína de fusão (F). Estirpes patogênicas emergem de não-patogênicas por mutação no código genético para presença de aminoácidos básicos no sítio de clivagem de F (resíduos 111-116 e fenilalanina em 117).
Por muitos anos pensou-se haver aves na condição de reservatórios assintomáticos de estirpes patogênicas, mas isto não se confirmou cientificamente.
As evidências científicas da mutação em F para maior patogenicidade foram demonstradas em episódios de doença de Newcastle na Austrália [20, 40]. Os isolados de APMV-1 podem ser classificados como velogênicos, mesogênicos e lentogênicos, de acordo com a virulência para embriões, pintinhos ou franguinhas [1].
As estirpes velogênicas são altamente patogênicas e podem resultar em 100% de mortalidade em aves de qualquer idade, com a caracterização, quanto ao tropismo, em viscerotrópicas (hemorragias gastrointestinais e diarreia) ou em neurotrópicas (lesões no sistema nervoso central e sinais nervosos).
Estirpes mesogênicas causam lesões respiratórias moderadas, raramente neurológicas e resultam em baixa mortalidade e até mediana mortalidade. As estirpes lentogênicas, apesar de pouco virulentas e usadas como vacinas, podem determinar infecções secundárias e diminuição da produção de carne e ovos [1, 8].
A caracterização de APMV-1 pode ser obtida por inoculação experimental em aves SPF: embriões, pintinhos e ou franguinhas. As estirpes causadoras de doença apresentam virulência superior a 0,7 para o índice de patogenicidade intracerebral (IPIC) em pintinhos SPF de 1 dia de idade [1, 6, 7, 25].
As estirpes patogênicas têm múltiplos aminoácidos básicos no sítio de clivagem da glicoproteína da fusão, com os aminoácidos Arginina ou Lisina nas posições 113-116 e Fenilalanina na posição 117 (fórmula 113RXR/KR*F117 – 113Arginina, 114Glutamina/qualquer, 115Arginina/ Lisina, 116Arginina e 117Fenilalanina) [1, 25].
Esta composição é necessária para a ativação enzimática, que ocorre intracelular por furina do complexo de Golgi. A proteína F0 recém formada é ativada em F1 e F2 pela furina, e permite infectividade aos novos vírions que emergem da célula, procederem a fusão e penetração. Mecanismo semelhante ocorre com as estirpes patogênicas do vírus de influenza aviária (HPAIV). As estirpes não patogênicas (lentogênicas) não possuem esta composição e por isto não são ativadas no complexo de Golgi, não emergindo infectantes da célula.
As diferenças em patogenicidade residem principalmente na clivagem ou não da glicoproteína da fusão, ativação que permite a fusão do vírus à célula. APMV-1 é envelopado e depende da integridade do envelope para promover a adsorção e penetração na célula alvo. A infecciosidade é destruída por detergentes e desinfetantes (formol, cresol, hipoclorito de sódio, iodo, quaternário de amônia, etc.), comumente empregados na avicultura, embora haja reduzida eficiência desinfetante quando protegidos por matéria orgânica.
As estirpes de APMV-1 naturalmente não patogênicas (lentogênicas) têm IPIC < 0,7 e têm sido usadas como vacinas vivas e inativadas no Brasil e em todo o mundo. A infecção não resulta em doença, exceto em condições de baixa higiene e/ou baixa renovação/baixa qualidade do ar [1,25].
Epidemiologia
A transmissão da DN é horizontal, direta de ave doente ou portadora para ave susceptível, com a inalação de aerossóis respiratórios ou das fezes, ou indireta por utensílios, alimento ou pessoal contaminado. Humanos sem proteção prévia são susceptíveis à conjuntivite por NDV e transmitem vírus. As aves da ordem Anseriformes (pato, ganso) infectam-se, mas são mais resistentes à manifestação da doença, sendo por isto importante fator de risco para aves galináceas. As aves da ordem Galliformes (galinha, peru, faisão, pavão) estão entre as mais sensíveis [1, 25].
APMV-1 tem um amplo espectro de hospedeiros, ocorrendo em pelo menos 247 espécies de aves, em 27 das 50 ordens de aves conhecidas, incluindo todas as espécies domésticas e muitas silvestres e semi-silvestres ou criadas em cativeiro, infectadas natural ou experimentalmente [19].
Destaca-se a complicada epidemiologia, com muitas espécies potenciais fontes de APMV-1, condição que exige extremo rigor em biosseguridade e ou imunoproteção para as criações de galinhas, perus e outras aves da indústria avícola. As aves da ordem Columbiformes podem ser infectadas com estirpes de APMV-1 próprias, designados paramixovirus dos pombos (pigeon paramyxovirus 1, PPMV-1), mas são também suscetíveis a infecção por estirpes de galinhas [31].
PPMV-1 também causa lesões graves em galinhas infectadas, especialmente atingindo o coração e encéfalo. Os pombos domésticos (Columba livia) devem ser considerados como fonte potencial de APMV-1 e de risco para criações comerciais [21]. Anticorpos monoclonais para a hemaglutinina foram usados para tipificar as estirpes de APMV-1 de pombos, responsáveis por surtos de DN em galinhas no Reino Unido em 1984 [2, 30].
Da mesma forma, algumas espécies de aves selvagens podem ser importantes na disseminação do vírus da doença de Newcastle [4]. A eliminação do vírus pode ocorrer durante um ano em papagaios verdadeiros (Amazona aestiva) e por cerca de 80 dias por canário (Serinus canária), periquito australiano (Melopsittacus undulatus), mynah comum (Gracula religiosa) e manon-de-cabeça-negra (Lonchura atricapilla) [31]. Equipes de vacinação que transitam entre granjas foram implicadas em surtos de DN [Utterbach]. Surtos foram também relatados por inativação incompleta de vacinas inativadas [36] e a contaminação de vacinas [18].
Durante o curso da infecção por uma estirpe velogênica do VDN, a maioria das aves excreta grande quantidades de vírus nas fezes, que se constituem no principal meio de disseminação do vírus da doença de Newcastle de ave para ave. O vírus da doença de Newcastle (VDN) possui a capacidade de se difundir por todo o mundo por meio de aves suscetíveis, pessoas, equipamentos, ar, ração, água contaminada, vacinas, veículos e até por espécies não aviárias, entre as quais, pequenos roedores e insetos [1].
A transmissão do vírus ocorre pelo contato com produtos como ração ou utensílios (bebedouros, comedouros) contaminados, ou por aerossóis de fezes ou produzidos na respiração de aves infectadas. A infecção pode ocorrer pela inalação do vírus excretado por aves com sinais respiratórios. A replicação intestinal resulta em maior amplitude de contaminação, por exemplo, da água e alimentos, sendo importantes fontes de infecção [1].
Ocorrência mundial
O primeiro surto da doença ocorreu em 1926, em Java, na Indonésia e em Newcastle, na Inglaterra. No entanto, alguns autores reconhecem que surtos anteriores podem ter ocorrido na Europa Central, Coréia e ilhas no oeste da Escócia [1].
Mesmo com as medidas de biosseguridade e vigilância sanitária, ainda há surtos que ocorrem em todo o mundo, por exemplo, no México (fevereiro de 2006), Azerbaijão (fevereiro de 2006), Ucrânia (fevereiro de 2006), Japão (maio de 2006), França (novembro de 2006), Brasil (novembro de 2006), Suíça (novembro de 2006), Latvia (novembro de 2006), Reino Unido (novembro de 2006), Itália (dezembro de 2006), Sérvia e Montenegro (dezembro de 2006), Turquia (dezembro de 2006), Bulgária (dezembro de 2006), Romênia (dezembro de 2006), Bangladesh (junho de 2007), Congo (janeiro e junho de 2007), Grécia (junho e dezembro de 2007), Guinea (julho e dezembro de 2007), Malásia (julho de 2007), Filipinas (dezembro de 2007), África do Sul (julho e dezembro de 2007), México (julho e dezembro de 2007), Bulgária (fevereiro e março de 2008), Romênia (fevereiro e março e abril de 2008), Alemanha (abril de 2008), Suécia (abril de 2008), Chile (maio de 2008), Finlândia (junho de 2008), Eslováquia (julho de 2008), Itália (julho de 2008), Finlândia (julho de 2008), Peru (setembro de 2008), Peru (setembro de 2008), Suécia (novembro de2008), Belize no Caribe (novembro de 2008), Bulgária (dezembro de 2008), Suécia (dezembro de 2008), Japão (dezembro de 2008) e Belize no Caribe (dezembro de 2008) [25].
As ocorrências mundiais no segundo semestre de 2014 estão destacadas no mapa de distribuição publicado pela OIE [25] (Fig. 1).
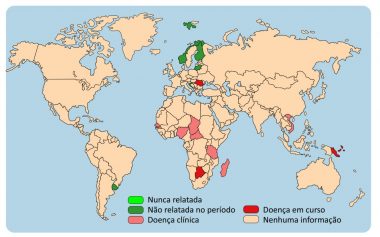
Fig. 1. Ocorrências de doença de Newcastle no segundo semestre de 2014. Com exceção da Romênia (Europa), os demais países em vermelho concentram-se no continente africano e asiático. World Animal Health Information Database (WAHID) – Version 1. Copyright © World Organisation for Animal Health (OIE), [25], Acesso em 08/03/2015.
Ocorrência no Brasil
No Brasil, a DN teve o primeiro relato de surto em Belém (PA) e Macapá (AP), em 1953 [33], com a suspeita de importação de carcaças congeladas de aves de corte procedentes dos Estados Unidos da América, para um dos hotéis da capital paraense [38] e isolamento da estirpe M33 [9].
A partir desta data, a doença foi observada em todo o território nacional, ocasionando graves perdas econômicas à avicultura [15]. Nos anos seguintes foram assinalados vários surtos em aves reprodutoras, comerciais, criadas em galinheiros domésticos e/ou em aves caipiras [3, 9, 27, 34]. Os episódios resultaram em elevados prejuízos à avicultura nacional, incluindo o comprometimento do comércio internacional de produtos de origem avícola.
No Brasil, desde 1994 está em vigor, instituído pelo MAPA (Ministério da Agricultura, Pecuária e Abastecimento) o Programa Nacional de Sanidade Avícola (PNSA), que estabelece normas de biosseguridade, vacinação e sacrifício de aves com confirmação laboratorial de estirpes patogênicas de APMV-1, em todas as regiões avícolas [6, 7].
Desde 1997, não foram relatados surtos em criatórios comerciais. Em 1997, foram descobertas estirpes virulentas de APMV-1 em avestruzes importados (São Paulo), no Paraná em pássaros exóticos também importados. Os surtos mais recentes ocorreram em galinhas e patos de fundo de quintal foram notificados no Rio de Janeiro e Goiás, em 2000 e 2001, respectivamente, e em 2006 no Rio Grande do Sul, Amazonas, Mato Grosso [26] e novo surto no Amazonas em 2008 [29].
Em 7 de abril de 2006, o MAPA, pela Instrução Normativa nº 17, resolve aprovar (com fundamento na Portaria Ministerial nº 193, de 19 de setembro de 1994, e o que consta do Processo no 21000.001074/2006-37), no âmbito do Programa Nacional de Sanidade Avícola, o Plano Nacional de Prevenção da Influenza Aviária e de Controle e Prevenção da Doença de Newcastle [6, 7]. Contudo, a rota de aves migratórias no Estado do Maranhão, foi incluída na vigilância do PNSA, com a Instrução Normativa nº 17 (IN), somente em 2008 [32].
O PNSA, com prioridade para o enfrentamento da influenza e doença de Newcastle, é estruturado por uma rede de laboratórios oficiais e credenciados que promovem a vigilância nos principais polos de produção. A vigilância baseia-se na notificação obrigatória, diagnóstico laboratorial, assistência aos focos, medidas de biosseguridade, desinfecção e sacrifício sanitário, entre outras.
Por se tratar de vírus que pode infectar todas as espécies aviárias, incluindo aves silvestres de vida livre ou cativeiro e de criações caseiras, a avaliação amostral deve incluir também estas aves, especialmente durante o combate ao foco. Em relação às aves de fundo de quintal, embora devam ser considerados os aspectos socioeconômicos envolvidos, o sacrifício sanitário não está acompanhado de uma política de indenização. Desta forma, o pequeno criador pode restringir o acesso de sua propriedade aos grupos de pesquisa [28].
Para reforçar a importância de aves silvestres na epidemiologia da doença de Newcastle [35] foram analisados o soro sanguíneo de 103 pardais (Passer domesticus) capturados em granjas de corte (24/103) e postura (79/103) localizadas no estado de Pernambuco, através do teste de inibição da hemaglutinação e, detectou-se títulos de anticorpos que variaram entre 2 e 64 em 10,68% das aves, com sorologia positiva e isolamento viral obtidos de pardais provenientes de granjas de postura.
Sinais clínicos e lesões
A DN por estirpes mesogênicas ou velogênicas pode atingir diversos sistemas, principalmente os sistemas respiratório, gastrointestinal e nervoso central e, varia em severidade, com a estirpe de vírus, o perfil imune e quanto à espécie de ave.
As estirpes velogênicas causam alta mortalidade, de até 100%, especialmente em aves susceptíveis (não imunes), por não terem sido vacinadas ou sem contato prévio com o NDV.
Clinicamente, com estirpes mesogênicas, a DN caracteriza-se por sinais respiratórios, incluindo conjuntivite (de lacrimejamento até hemorragia), corrimento nasal, diarreia, hemorragias (úlceras) intestinais e sinais nervosos centrais (incoordenação motora, opistótono, torcicolo).
Estirpes velogênicas causam quadros muito mais graves, com alta mortalidade súbita (superagudos), muitas vezes sem sinais. Os sinais clínicos e lesões não são patognomônicos e podem ser confundidos com outra doenças, razão para que o diagnóstico definitivo dependa de exame laboratorial [1, 6, 7, 25, 39].
As lesões no sistema nervoso central podem resultar em falta de coordenação motora e torcicolo (Fig. 2).

Fig. 2. Galinha com torcicolo. Estirpes velogênicas neurotrópicas podem causar sinal semelhante.
Entretanto, neste caso, a causa foi lesão vestibular e facilmente diferenciável por não haver distribuição no plantel e mortalidade.
Entretanto, são várias as causas de incoordenação, de deficiências nutricionais, outras doenças infecciosas (encefalomielite aviária, colibacilose) e intoxicações. A infecção inicial é comumente na conjuntiva ocular, onde ocorre hemorragia (Fig. 3), assim como na traqueia (Fig. 4), moela e proventrículo (Fig. 5).
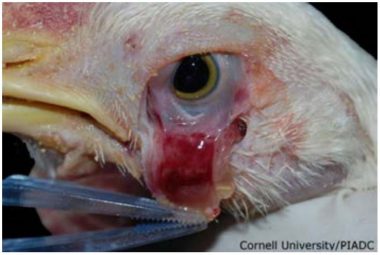
Fig. 3. Frango com conjuntivite. Infecção experimental com estirpe velogênica. Notar a abordagem de análise da conjuntiva ocular (Fonte: Cornell University, acesso em 08/03/2015).
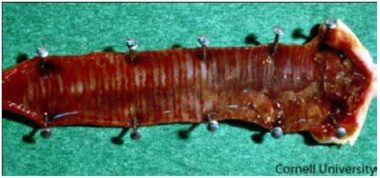
Fig. 4. Traqueia de ave experimentalmente infectada por estirpe velogênica. Notar a congestão difusa e focos de hemorragia traqueal. (Fonte: Cornell University, acesso em 08/03/2015)
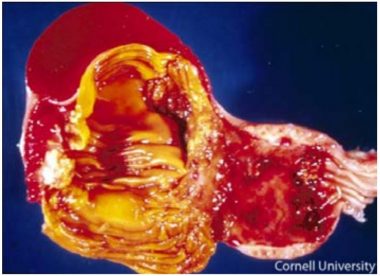
Fig. 5. Proventriculo e moela de ave experimentalmente
infectada com estirpe velogênica. Proventriculite com hemorragia multifocal na mucosa (Fonte: Cornell University, acesso em 08/03/2015).
Diagnóstico
A DN é de notificação obrigatória por lei. Entretanto, para a notificação de surto assume-se responsabilidade legal, pelas consequências econômicas e sociais e, assim, sendo imputáveis, negligência e demora ou a informação irresponsável. A suspeita será fundamentada por Médico Veterinário habilitado, se atender ao quadro clínico-patológico descrito e em plantel não vacinado. Em termos gerais, reduz-se a probabilidade de DN em planteis adequadamente vacinados e com títulos de anticorpos superiores a 32.
Para a confirmação laboratorial, é necessário convocar o serviço oficial de vigilância no Estado (IMA), que fará a colheita de material e o envio ao laboratório de referência (LANAGRO, Campinas, SP).
No Brasil pode-se cogitar a possibilidade de surto de DN, por ocasião de doença de média ou alta mortalidade, especialmente em aves galináceas não vacinadas contra a DN. Toda a mortalidade acima de 1% no transporte e 10% na criação deve ter sua causa identificada [6, 7]. Diagnósticos diferenciais devem ser encaminhados nos casos de alta mortalidade, quando houver indicação/suspeita de envenenamentos, intoxicações, pasteurelose, salmonelose ou outras doenças que causam hemorragias, sinais respiratórios e nervosos.
Considerando que os sinais clínicos e lesões não são patognomônicos e podem ser confundidos com outra doenças, o diagnóstico definitivo depende de exame laboratorial [1, 6, 7, 25, 39].
Não há razão, neste momento, para a suspeita de influenza aviária de alta patogenicidade, por estirpes asiáticas ou mesmo por estirpes locais no país. Entretanto, cresce a preocupação, com o diagnóstico de estirpes recombinantes H5N1, H5N2 e H5N8 em aves aquáticas na América do Norte. A vigilância de DN ocorre em paralelo com a vigilância de influenza aviária. Os estudos de monitoração de aves migratórias não têm encontrado estirpes de preocupação, mas apenas de baixa patogenicidade [Golono, 2009].
APMV-1 pode ser isolado em embriões de galinhas (SPF, livres de patógenos específicos), inoculados aos 8-11 dias de incubação via cavidade córioalantóide (Fig. 6).

Fig. 6. Inoculação embrionária via cavidade corioalantoide
A replicação viral resulta em atividade hemaglutinante (Fig. 7) no líquido cório alantóide (LCA).
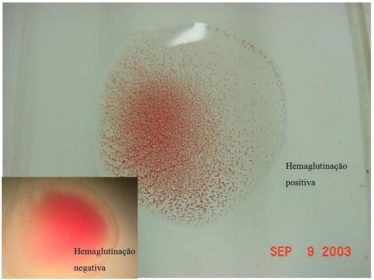
Fig. 7. Atividade hemaglutinante de líquido corioalantoide frente a hemácias de galinhas SPF a 5%.
O diagnóstico oficial da DN está regulamentado pelo MAPA no PNSA [Brasil 2009 a, b] e deve ser executado em laboratório credenciado. O isolado de APMV-1 é caracterizado, no laboratório de referência, para diferenciação entre vírus vacinal (lentogênico) e de doença (mesogênico ou velogênico), como segue:
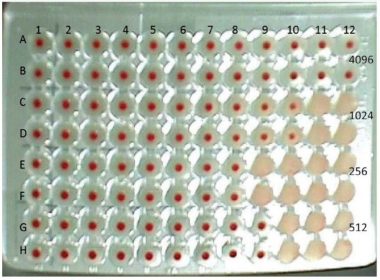
Fig. 8. Inibição da hemaglutinação em microplaca de 96 cavidades. Os testes de soros em duplicata
foram realizados com APMV-1 com quatro unidades hemaglutinantes. Nas linhas A e B, soro com título≥ 4096; linhas C e D, título 1024; linhas E e F, título 256; linhas G e H, título 512.
1) Tempo médio de mortalidade embrionária (TMME). Diluições (base 10) entre -6 e -9, utiliza-se 100 microlitros (0,1 mL) inoculados via cavidade alantóide, na cavidade cório alantoide (CCA) ou LCA em embriões SPF (8-11 d) em mínimo de 5 ovos por diluição e observados por 7 dias. A mais alta diluição com 100% de mortalidade determina estirpe velogênica para mortalidade em menos de 60 horas; mesogênica para mortalidade entre 61 e 90 horas e lentogênica para mortalidade em mais de 90 horas ou ausência de mortalidade embrionária. Anticorpos específicos para APMV-1 podem ser determinados com o teste de inibição da hemaglutinação (IH) (Fig. 8), com significância qualquer título acima de 8 em IH para aves não vacinadas. Para aves vacinadas, deve-se demonstrar o aumento de, no mínimo, dois logarítmos (em base 2) em média geométrica de títulos de anticorpos (resposta anamnéstica), comparando-se os títulos, no dia do atendimento e 15-21 dias após, por exemplo, a ascensão de 16 para 64.
2) Índice de patogenicidade intracerebral em pintos de 1 dia. Vírus de líquido cório-alantóide (LCA) com atividade hemaglutinante, diluído a 1:10 e livre de bactérias, 0,1 mL inoculado via intracerebral em pintos de 1 dia (SPF) e observados por oito dias (cada 24 horas). A interpretação e escores determina: 0 = normal; 1 = doente e 2 = morto, sendo o escore final a média de todos os oito dias. A interpretação determina serem velogênicas as estirpes com escore próximo de 2 e lentogênicas com escore próximo de 0.
3) Índice de patogenicidade intravenosa (IV) em frangas SPF de seis semanas, inoculadas com 0,1 mL de líquido cório alantoide hemaglutinante, diluído a 1:10 e livre de bactérias, inoculado IV em 10 aves (SPF) e 10 dias de observação diária: escore 0 = normal; 1 = doente; 2 = paralítico; 3 = morto. Interpretam-se como estirpes velogênicas com escore próximo de 3 e lentogênicas com escore próximo de 0.
Os escores de IPIC de vacinas vivas mais em uso no Brasil são Hitchner B1 (HB1) 0,2 e La Sota 0,4. As estirpes enterotrópicas assintomáticas têm escore de IPIC 0,0.
Os métodos de análise do genoma permitem a caracterização dos isolados, com transcrição reversa do RNA para DNA e amplificação (PCR). APMV- 1 contém genoma RNA e necessita de transcrição reversa em cDNA para execução da PCR.
A parte do genoma de APMV-1 que permite a caracterização da patogenicidade é a que codifica a região de clivagem da glicoproteína de fusão.
O produto amplificado pode ser examinado com enzimas de restrição ou seqüenciamento. As estirpes patogênicas (mesogênicas e velogênicas, com IPIC > 0,7) têm na região codificadora do sítio de clivagem da hemaglutinina, código para múltiplos aminoácios básicos (Arginina e/ou Lisina nos resíduos 113-116 e Fenilalanina em 117) [Alexander, 2003; OIE, 2012; Wakamatsu et al., 2007].
Apenas a demonstração de contato com APMV-1 por testes sorológicos ou isolamento viral, sem a definição da patogenicidade do vírus infectante, não é suficiente para imposição das medidas de controle, pois, cepas lentogênicas do vírus ocorrem em pássaros de todo o mundo e o uso de vacinas vivas é quase universal (Alexander, 2003).
Desse modo, técnicas moleculares foram desenvolvidas em anos recentes com o intuito do diagnóstico definitivo rápido da patogenicidade [Alexander, 2003, Wakamatsu et al., 2007]. Entretanto, o diagnóstico pode ser dificultado pela presença de inibidores da PCR em muitos órgãos e tecidos, especialmente sangue e fezes (Gohm et al., 2000) e pela dificuldade de extração de RNA dos tecidos fixados pelo formol (Farragher et al., 2008).
Imuno-histoquímica (Kommers et al., 2001) e hibridização in situ (Brown et al., 1999) em tecidos fixados em formol foram valiosos para diagnóstico e determinar a distribuição viral (Brown et al., 1999; Wakamatsu et al., 2007). Há perspectivas de hibridização in situ fluorescente (FISH) ter forte impacto na obtenção de imagem da célula viva e no diagnóstico médico (Levsky e Singer, 2003).
Estudos recentes utilizando a técnica FISH têm mostrado resultados rápidos e altamente sensíveis (McCarthy et al., 2008; Jergens et al., 2009). Entretanto, a detecção de mínimas quantidades do vírus não é possível com essas técnicas (Wakamatsu et al., 2007).
Prevenção e controle
Os núcleos ou granjas de produção e de reprodução (matrizes, avós ou bisavós), devem estar localizados em áreas livres de estirpes patogênicas de APMV-1. A zona livre da doença de Newcastle é o território geográfico definido legalmente com extensão de pelo menos de dez quilômetros em torno do estabelecimento.
O Manual de Legislação [Brasil 2009 a, b] determina que os estabelecimentos avícolas que realizam comércio internacional devem cumprir, além de outros procedimentos estabelecidos pelo MAPA, as exigências dos países importadores. No Art. 27, determina-se que a vacinação nos planteis de aves de reprodução e comerciais somente poderá ser realizada com vacina devidamente registrada no MAPA. O programa de vacinação deverá ser específico por região e por segmento produtivo.
As aves reprodutoras, à exceção de aves SPF, de postura comercial e aves ornamentais realizarão vacinação sistemática contra a DN. Os estabelecimentos de frangos de corte que realizarem vacinação para DN e outras doenças de controle oficial deverão obrigatoriamente informar a atividade ao serviço estadual de defesa sanitária animal.
No Brasil a DN pode ser prevenida por vacinação, com vacinas vivas preparadas com estirpes não patogênicas (lentogências) do NDV, por exemplo no 1º dia de vida (estirpes Hitchner B1 ou HB1) e revacinações periódicas (estirpe La Sota). Para aves de maior longevidade (poedeiras e reprodutores), o programa vacinal geralmente inclui revacinações com vacina viva durante o crescimento e a revacinação com vacina inativada via intramuscular antes da postura.
O risco de desafio dos planteis pode ser reduzido com a implantação de plano de biosseguridade, com confinamento e distanciamento, para evitar o contato com aves potencialmente portadoras, principalmente da ordem Anseriformes.
Entretanto, as infecções com estirpes lentogênicas, mesmo vacinais, podem ter impacto em plantéis infectados por Mycoplasma gallisepticum ou Escherichia coli, infecções que podem ser controladas com antibioticoterapia antes e depois da vacinação. Os estudos australianos confirmaram a emergência de estirpes patogênicas (meso e velogênicas) a partir de não patogênicas (lentogênicas), por mutação na região de clivagem da glicoproteína de fusão [Kirkland, 2000; Westbury, 2001].
Referências
1. ALEXANDER, D. J. Newcastle disease and other paramyxovirus infections. In: CALNEK, B. W. et al. Diseases of poultry. 10.ed. Ames: Iowa State University Press, p.64-87, 2003.
2. ALEXANDER, D. J., P. H. RUSSELL, G. PARSONS et al. Antigenic and biological characterisation of avian paramyxovirus type 1 isolates from pigeons—An international collaborative study. Avian Pathol 14:365—376, 1985.
3. ALICE, F. J. et al. Ocorrência da doença de Newcastle na Bahia. Boletim do Instituto Biológico, Salvador, v. 3, p. 124-31, 1956.
4. AWAN, M.A. et al. The epidemiology of Newcastle disease in rural poultry: a review. Avian Pathology Huntingdon, v. 23, p. 405-423, 1994.
5. BOLETIM INFORMATIVO nº 925, semana de 21 a 27 de agosto de 2006, FAEP – Federação da Agricultura do Estado do Paraná. Ministério da Agricultura confirma foco de Newcastle no Amazonas.2006.
6. BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Plano de contingência para influenza aviária e doença de Newcastle. 2009. Disponível em: http://www.oie.int/fileadmin/ Home/esp/Animal_Health_in_the_World/ docs/pdf/PLANO_DE_CONTINGENCIA_ VERS_C3O_1.3_JULHO_2009.PDF
7. BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Manual de Legislação. Programas Nacionais de Saúde Animal do Brasil. 2009. 441 pp. Disponível em: http://www.agricultura. gov.br/arq_editor/file/Aniamal/Manual%20 de%20Legisla%C3%A7%C3%A3o%20-%20 Sa%C3%BAde%20Animal%20-%20low.pdf
8. BROWN, C.; KING, D.J.; SEAL, B.S. Pathogenesis of Newcastle Disease in Chickens Experimentally Infected with Viruses of Different Virulence.Veterinary Pathology. v. 36, p. 125-132, 1999.
9. CUNHA, R. G.; SILVA, R. A. Isolamento e identificação do vírus da Doença de Newcastle no Brasil. Sociedade Brasileira de Medicina Veterinária, v. 23, p. 17-33, 1955.
10. FARRAGHER, S.M.; TANNEY, A.; KENNEDY, R.D.; HARKIN, D.P. RNA expression analysis from formalin fixed paraffin embedded tissues. Histochemistry Cell Biology. v. 130, p. 435-445, 2008.
11. FLORES, M.L.; SEGABINAZE, S.D.; SANTOS, H.F.; BASSAN, J.D.L. Epidemiologia da Doença de Newcastle – Revisão bibliográfica. A Hora Veterinária. n. 153, p. 57-61, 2006.
12. GOHM, D.S.; THUR, B.; HOFMANN, A. Detection of Newcastle disease virus in organs and faeces of experimentally infected chickens using RT-PCR.Avian Pathlogy. n. 29, p. 143-152, 2000.
13. GOLONO, M.A. Epidemiologia e caracterização molecular de virus da influenza em aves residentes e migratórias no Brasil [tese]. São Paulo (SP): Universidade de São Paulo; 2009. 102 p.
14. HASTENREITER, H. La maladie de Newcastle au Brésil.Bulletim Official International Epizzoties, v.85, p.813-817, 1976.
15. ICTVdB Management (2006). 01.048.1.05.001.13.012.002. Newcastle disease virus WA2116. In: ICTVdB – The Universal Virus Database, version 4. Büchen-Osmond, C. (Ed), Columbia University, New York, USA.
16. JERGENS, A. E.; PRESSEL. M.; CRANDELL, J. et al. Fluorescent in situ hybridization confirms clearance of visible Helicobacter spp. associated with gastritis in dogs and cats. Veterinary Internal Medical. v. 2, n.1, p.16-23. 2009.
17. JØRGENSEN, P. H., K. JENSEN HANDBERG, P. AHRENS et al. Similarity of avian paramyxovirus serotype 1 isolates of low virulence for chickens obtained from contaminated poultry vaccines and from poultry flocks. Vet Rec 146:665—668, 2000.
18.KALETA, E. F.; BALDAUF. C. Newcastle disease in free-living and pet birds. In: ALEXANDER, D. J. Newcastle disease. Boston: KLUWER Academic Publishers, p. 197-246, 1988.
19. KIRKLAND, P. D. Virulent Newcastle disease virus in Australia: in through the ‘back door’. Austral Vet J 78:331-333, 2000.
20. KOMMERS, G.D.; KING, D.J.; SEAL, B.S.; BROWN, C.C. Virulence of pigeon-origin Newcastle disease virus isolates for domestic chickens. Avian Diseases, v. 45, p. 906-921, 2001.
21. LEVSKY, J.M.; SINGER, R.H. Fluorescence in situ hybridization: past, present and future. Journal of Cell Science. v. 116, p. 2833-2838, 2003.
22. MAPA (MINISTÉRIO DA AGRICULTURA, PECUÁRIA E ABASTECIMENTO). Programa Nacional de Sanidade Avícola. Portaria nº 193 de 19 de setembro de 1994 – Secretaria de Defesa Agropecuária. Disponível na internet em http:// www.agricultura.gov.br/sislegis-consulta/consultarLegislacao. Acessadoem 22/02/2009.
23. McCARTHY, Ú.M.; URQUHART, K.L.; BRICKNELL, I.R.An improved in situ hybridization method for the detection of fish pathogens. Journal of fish Diseases. n. 31, p. 669-677, 2008.
24. OIE (Office International de Epizooties). Newcastle Disease. Terrestrial Manual capítulo 2.3.14. 2012. http://www.oie.int/fileadmin/ Home/fr/Health_standards/tahm/2.03.14_ NEWCASTLE_ DIS.pdf. Acessado em 05/03/2015.
25. OLIVEIRA JUNIOR, J. G. et al. Vírus da doença de Newcastle em aves não vacinadas no Estado do Rio de Janeiro. Ciência Rural, Santa Maria, v. 33, n. 2, p. 381- 383, 2003.
26. OLIVEIRA, R. L; GIRÃO, F.G.F. Prevalência da doença de Newcastle, Brasil, 1971-1979. In: VI CONGRESSO BRASILEIRO DE AVICULTURA, 1979, Belo Horizonte. Anais do VI Congresso Brasileiro de Avicultura, p.122-28, 2006.
27. OLIVEIRA, R. L. et al. Doenças de aves diagnosticadas em dois laboratórios de Belo Horizonte entre 1975-1980. In: 7o CONGRESSO BRASILEIRO DE AVICULTURA, 1981, Recife. Anais do 7o Congresso Brasileiro de Avicultura, p.248-59, 1981.
28. PAULILLO, A. C.; DORETTO JUNIOR, L. Doença de Newcastle. In: BERCHIERI JÚNIOR, A. & MACARI, M. (Eds.). Doenças das aves. Campinas: Fundação APINCO de Ciência e Tecnologia Avícolas, 2000, p.267-81. Jaboticabal: 2000.
29. PEARSON, J. E., D. A. SENNE, D. J. ALEXANDER et al. Characterization of Newcastle disease virus (avian paramyxovirus-1) isolated from pigeons. Avian Dis 31:105-111, 1987.
30. PEDERSEN, J.C.; SENNE, D.A.; WOOLCOCK, P.R. et al. Phylogenetic relationships among virulent Newcastle disease virus isolates from the 2002-2003 outbreak in North America. Journal of clinical Microbiology. v. 42, n. 5, p. 2329-2334, 2004.
31. PORTAL do Governo do Estado do Maranhão. Disponível em http://www.seagro.ma.gov. br/2008/4/17/Pagina660.htm. Capturado em 22/02/2009.
32. SANTOS, J. A. et al. A ocorrência da doença de Newcastle no Brasil (nota prévia). Revista de Produção Animal, v. 1, n. 1, p. 5-12, 1954.
33. SILVA, R.A. et al. Novos focos da doença de Newcastle no Brasil. Arquivos do Instituto Biológico Animal, v. 4, p. 109-114, 1961.
34. SILVA, J. S. A. et al. Newcastle disease vírus infection in sparrows (Passer domesticus, Linneaus, 1758) captured in poultry farms of the agreste region of the State of Pernambuco. Revista Brasileira de Ciências Avicolas, Campinas, v. 8, n. 2, p. 125-129, 2006.
35. SPALATIN, J. S. & R. P. HANSON. Recovery of a Newcastle disease virus strain indistinguishable from Texas GB. Avian Dis 10:372—374, 1966.
36. UTTERBACK, W. W. & J. H. SCHWARTZ. 1973. Epizootiology of velogenic viscerotropic Newcastle disease in southern California, 1971— 1973. J Am Vet Med Assoc 163:1080—1090, 1973.
37. VAITSMAN, J.; MOUTSSATCÉ, I. Doença de Newcastle. Boletim 801 do Serviço de informação Agrícola, Ministério da Agricultura, 56p. 1954.
38. WAKAMATSU, N.; KING, D.J.; SEAL, B.S.; BROWN, C.C. Detection of Newcastle virus RNA by reverse transcription-polymerase chain reaction using formalin-fixed, paraffin-embedded tissue and comparison with immunohistochemistry and in situ hybridization. Journal Veterinary Diagnostic Investigation. v. 19, p. 396-400, 2007.
39. WESTBURY, H. Commentary. Newcastle disease virus: an evolving pathogen. Avian Pathol 30: 5-11, 2001.
Cadernos Técnicos de Veterinária e Zootecnia, nº 76 – março de 2015