Conteúdo disponível em: English (Inglês)
O birnavírus causador da doença de Gumboro, não é o único que compromete a bursa de Fabricius e outros órgãos linfóides, porém é o mais importante.
O sistema imune é estratégico. A demanda por eficiência imune resulta da pressão ambiental, incluindo falha na biosseguridade e redução de uso dos antibióticos. Isso requer efetivos estímulos à resposta imune individual do animal, ou do rebanho, ao mesmo tempo com que se adéqua o galpão às cepas vacinais.

Vamos rever o sistema imune das aves, e sua maior ameaça, ou seja, a doença de Gumboro; sua imunopatologia, e as lesões advindas da “agressão”vacinal além de alguns pontos não muito considerados, quando o assunto é discutido.
O birnavírus causador da doença de Gumboro, não é o único que compromete a bursa de Fabricius e outros órgãos linfóides, porém é o mais importante, até pela resistência do mesmo e sua capacidade de contaminar as instalações, notadamente em face do hábito de reuso da “cama”, além da sua infecciosidade, patotipagem e mutabilidade (novas variantes).
Isso requer vigilância total dos produtores de vacina e monitoramento de campo.
MORFOLOGIA / HISTOLOGIA
O tecido linfóide se distribui pelo organismo, como na cavidade nasal, esôfago cervical e torácico, pró- ventrículo, placas de Peyer, tonsilas cecais, reto, além de timo, baço, fígado, entre outros.
Estão sempre presentes células dendriticas, células B e células T, e dependendo do folículo, o predomínio é de células B e por vezes, células T. O contato com o antígeno regula o desenvolvimento desses núcleos germinativos, notadamente no GALT.
Os órgãos primários, como a bursa de Fabricius e o timo ( células B e T, respectivamente), atrofiam com respectivamente 16 -e 17 ou mais semanas, e o tecido linfóide secundário, se encarrega de toda a reação imune.
O intestino é o maior tecido linfóide com milhares de conglomerados intra epiteliais e centenas de placas de Peyer (entre 200 a 300), além das tonsilas cecais.
A IMUNOPATOLOGIA

Na DG aguda, em animais entre 2 a 6 semanas, há inflamação “bursal” e severa depleção linfóide (necrose). A mortalidade varia de 20 a 30%, e macroscopicamente ocorre edema do órgão, e com a continuidade, depleção e atrofia.
O edema eleva seu peso a 6 g; perdura por 3 dias, com atrofia após 3-5 dias. Interessantemente há produção de anticorpos, a partir de células B maturas, multilocadas. Essas células resistem mais ao vírus que as imaturas.
O título da a.c, chega a 1: 1000. Essa patologia ocorre após declínio dos anticorpos passivos. A histopatologia mostra depleção a partir da medular dos folículos, com necrose linfóide e edema inflamatório, além de característica infiltração heterofílica.
Posteriormente os folículos retraem, com hipoplasia e atrofia, além de fibroplastia interfolicular,acompanhado de infiltração macrofágica nas regiões centrais. Ocorre formação pseudocística. A lesão regenera desde que se mantenha íntegra a membrana basal, a qual é revestida por células dendriticas ativantes de genes responsáveis pela clonagem de células B.
Esse fenômeno foi bem caracterizado por Ivan; J ( 2001) usando como marcador, o carboidrato de Lewis, que indica a conversão gênica. Isso relativiza bastante a bursometria e sua interpretação.
A forma clássica de DG, vem sendo substituída por aquelas devidas às variantes virais ( vvIBDV). Nessas, se observa uma rápida imunodepressão, com elevados índices de mortalidade, ocorrendo mais precocemente, e rompendo as defesas passivas com facilidade. A característica lesão bursal aguda e a fase clinica, podem não ser percebidas. As variantes dependem da região, e a patotipagem varia.
Essas variantes levaram às novas vacinas, programas e monitoramentos. Cepas suaves, intermediárias, intermediárias plus e quentes, estão ligadas ao nome do pesquisador que a descreveu, como Lukert, Winterfield etc, ou indicações alfanuméricas como D78, V 877 etc. Essas denominações, são confusas, e já foi proposto um novo sistema para designar esses isolados ( Jackwood, DJ; 2018)
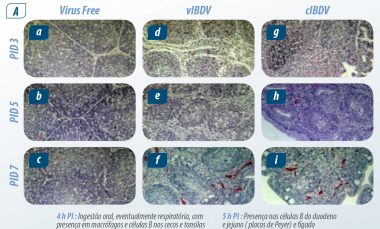
Imagem 1. Cinética da infecção (PI) Abdul R ( 2011)
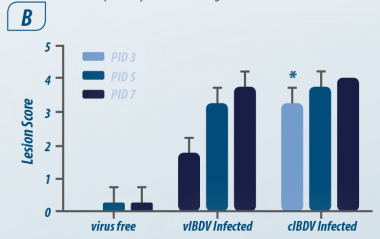
Após 5 h PI: Viremia primária e chegada à bolsa, seguido por viremia secundária em conglomerados linfóides em outros órgãos. Na bursa de Fabricius e no baço é onde o vírus atinge sua concentração máxima.
De acordo com Abdul R ( 2011); o vírus permanece na bursa de Fabricius por 21 dias, sendo baixíssima a concentração em outros tecidos.
O vírus permanece na “cama” dos frangos e na poeira por 60 e 28 dias respectivamente, requerendo a investigação da sobrevivência das cepas vacinais, importante no controle epidemiológico.
Resumindo, o birnavírus afeta células B com receptor IgM em fase de divisão. Já as células T são totalmente refratárias e importantes na inflamação e controle viral. Assim, como resultado da divisão viral nessas últimas, há inflamação, necrose/apoptose e depleção.
Essa lesão é também produto de cepas vacinais, como as intermediárias plus por exemplo. As lesões refletem o “take” da vacina, que guarda relação com os anticorpos passivos. O anticorpo ativo se produz nos núcleos germinativos.
ENVOLVIMENTO DAS CÉLULAS NA RESPOSTA IMUNE/INFLAMATÓRIA E ADAPTATIVA


A rigor o TH1 libera as IL1, IL3, IL15, IL17, com várias células alvo entre macrófagos e outras. Já o TH2 libera as interleucinas, IL3, IL4, IL5, IL9, IL10, IL13, basicamente com os mesmos alvos. A tendência é sempre o equilíbrio entre essas interleucinas e suas funções. Por exemplo, a interleucina não inflamatória, como a IL10, contrabalança os efeitos da IL12, nitidamente inflamatória. Nas avaliações laboratoriais, em geral usando ELISA ou biologia molecular, as IL6, IL18, IL8, IL12, IL1, IFN gama, são essencialmente inflamatórios. As células T ativadas também produzem proteínas líticas, como as perforinas, que participam da necrose das células B infectadas.

Por outro lado o linfócito T CD8 é toxigênico para células que albergam antígenos, principalmente virais, e as células NK ( neutral killers), um tipo de linfócito, intervém quando os outros mecanismos de “limpeza”falham, e não são capazes de reconhecer células infectadas. Essas células também dependem de interleucinas.
O acima exposto é uma noção do processo de resposta, e a abordagem de todos os mecanismos imune escapam ao objetivo dessa revisão. Tampouco se mencionou a maneira pela qual os macrófagos e células apresentadoras de antígenos contatam com os diversos agentes patogênicos antes de iniciar a cascata “imunidade inata/adquirida”.
Nessas células existem dezenas de receptores capazes de reconhecerem antígenos (TLRs), e no caso do birnavirus, principalmente o TLR 3. Importantes são também alguns receptores de globulinas (FCyR), envolvidos na ligação com os imunocomplexos.
Na bibliografia se incluem algumas referências que podem ser úteis a quem quiser se aprofundar.

A IMUNOPATOLOGIA DAS CEPAS VACINAIS









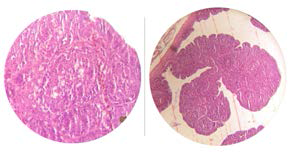
Imagem 2: Bolsa de aves vacinadas exibindo hipoplasia folicular e retração folicular com aproximadamente 14 dias após vacinação
Imagem 3: Bolsa de aves vacinadas, exibindo total repopulação linfoide Aproximadamente 28 dias após.
Vantagens potenciais advindas do uso dessa tecnologia ( Haddad E.E; 2016):





O autor chama a atenção quanto à excelência do arsenal vacinal que se dispõem no Brasil, mas também à necessidade de monitoramento efetivo de uso e a perfeita caracterização da sobrevivência das cepas vacinais no ambiente.
BIBLIOGRAFIA
1) Bernardino A. Doença infecciosa da bolsa de Fabricius. Doença das aves. 2nd Edição. FACTA 2009
2) Bordin E.L. Diagnóstico histopatológico. Doenças das aves. 2nd Edição. FACTA 2009
3) Cheville N. Studies of the pathogenesis of Gumboro disease in the BF, spleen, thymus of chicken. Veterinary Pathology 1979
4) Haddad E. A message from the immune system: A vaccine technology in needs of exploration. Journal of vaccine and vaccination 2016
5) Ivan J. Functional restoration of BF following “in ovo” infectious vaccine. Veterinary Immunopathology 2001
6) Jackwood DJ. A proposed nomenclature for infectious bursal disease virus isolates. Avian Pathology 2018
7) Rauf A. Persistence, distribution and immunopathogenesis of bursal disease virus in chickens. PhD dissertation thesis. Ohio State University
🔒 Conteúdo exclusivo para usuários registrados.
Cadastre-se gratuitamente para acessar este post e muitos outros conteúdos especializados. Leva apenas um minuto e você terá acesso imediato.
Conecte-seRegistre-se em aviNews
CADASTRE-SE