Conhecendo o metapneumovírus aviário
Patologia e Saúde Animal
Pneumovírus aviário no continente americano
Para ler mais conteúdo de aviNews LATAM
Patologia e Saúde Animal
Para ler mais conteúdo de aviNews LATAM
Conteúdo disponível em:
Español (Espanhol)
Desde o momento de sua identificação como agente causador da SHS, o aMPV não continua a associar-se a quadros clínicos em diferentes países e em diferentes tipos de ave.
Esta situação é resultado direto de um melhor diagnóstico laboratorial dos casos clínicos suspeitos e de um interesse cada vez maior na utilização de produtos preventivos frente a produtos curativos.
Conhecendo o metapneumovírus aviário
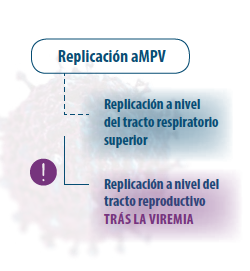
O metapneumovírus aviário se espalha no trato respiratório superior em aves de qualquer idade, desde o momento do nascimento (Hafez 1993; Cook 2000), e no trato reprodutivo após a fase de viremia.
É transmitido horizontalmente, por contato direto ou indireto com partículas eliminadas no aerosol pelas aves enfermas (Jones et al., 1986; Cook et al., 1991; Panigrahy et al., 2000; Alkhalaf et al., 2002).
Se espalha em células dos epitélios ciliados dos cornetes nasais e traqueia, provocando uma deformação e perda dos cílios nestas áreas, o que facilita uma maior penetração de agentes secundários (Majó et al. 1996) que complicam e agravam o processo patológico.
24 horas pós infecção podemos detectar o pneumovírus aviário na cavidade nasal e traqueia, onde a máxima quantidade de vírus é obtida entre os 3 e os 6 dias pós infecção.
FRANGOS
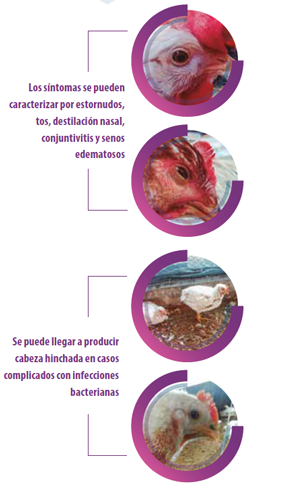
A infecção causada pelo aMPV favorece o estabelecimento e manifestação de infecções respiratórias secundárias em frangos e perus, como demostrado com vários patógenos respiratórios (Naylor et al., 1992; Van de Zande et al., 2001; Marien et al., 2005; Van Loock et al., 2006).
REPRODUTORAS & POEDEIRAS
As reprodutoras e poedeiras, também são suscetíveis de sofrer uma replicação viral no oviduto, sofrendo queda na posta e afetando a qualidade da casca do ovo. Também podemos chegar a identificar sintomatologia nervosa, torticolo e opisthotonos devido a infecções bacterianas ascendentes do ouvido médio, que produzem uma osteomielite do crânio (Majó et al. 1996).
Em todas as aves de produção, o estresse produtivo supõe um fator desencadeante da maioria dos quadros clínicos, chegando ao pico em poedeiras e reprodutoras, sendo este momento o mais comum na aparição de casos clínicos.
Diagnóstico clínico
O diagnóstico clínico não é 100% confiável: só pode ser utilizado como um guia de aproximação ao diagnóstico definitivo. É habitual encontrar situações nas quais as infecções produzidas pelo aMPV geram quadros clínicos que podem ser confundidos com:
as doenças provocadas pelo aMPV geram quadros clínicos que podem ser confundidos com qualquer enfermidade de tipo respiratória
Diagnóstico definitivo
O diagnóstico definitivo deverá ser alcançado a partir da interpretação de provas laboratoriais, principalmente sorologia (ELISA), e como confirmação em casos duvidosos, mediante o uso do diagnóstico por PCR. O diagnóstico definitivo é complicado devido ao breve período no qual podemos localizar o vírus no tecido alvo e a baixa sintomatologia que manifestam durante esses momentos(1), sendo possível detetá-lo até os 17 dias pós inoculação (2). Felizmente, a maioria dos países da América Latina dispõem de bons serviços diagnósticos (públicos e/ou privados) que podem ajudar no diagnóstico do aMPV
(1) Baxter-Jones & Jones, 1989; Alexander 1991; Majó et al. 1995
(2) Jing et al. 1993
O maior problema se presenta nos países donde a enfermidade não foi declarada e onde os kits ELISA não estão registrados por falta de interesse comercial dos laboratórios, ou por recusa do registro por parte das autoridades sanitárias. Nestes casos o diagnóstico é difícil e lento, podendo atrasar a aplicação de medidas preventivas ou corretoras. Nos países em que não se dispõe de kits ELISA comerciais, principalmente, utilizamos a detecção do vírus mediante PCR
Em nosso caso, graças ao serviço de ELISA -CIVTEST TRT- e de PCR real time -AVIANPNEUMOCHECK- dos serviços da Diagnos distribuído pela América Latina -Brasil, México, Peru…- fornecemos um serviço essencial para o correto diagnóstico, monitoramento e controle do aMPV.
Programas de vacinação utilizados na América Latina
Na atualidade, na América Latina existe diversidade quanto aos programas vacinais em função do status da enfermidade em cada país, assim como de diferentes situações epidemiológicas.
Vacinas inativadas
Nos países onde se permite somente o uso de vacinas inativadas (como por exemplo o México, Colômbia, República Dominicana…), os programas de vacinação são realizados com base na epidemiologia de cada região. Habitualmente se trabalha com duas doses de vacina inativada, a primeira dose sempre antes do primeiro contato com o vírus do campo e a segunda dosies entre 2 e 3 semanas antes da transferência das aves às granjas de produção.
Segundo os resultados obtidos dos serviços diagnósticos do HIPRA no México e Colômbia, os lotes de aves reprodutoras e poedeiras analisados são positivados entre 6 e 12 semanas de idade, em função da região de criação.
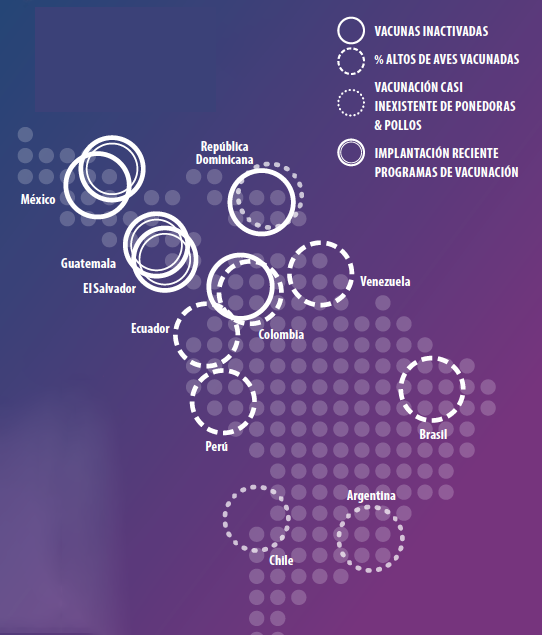
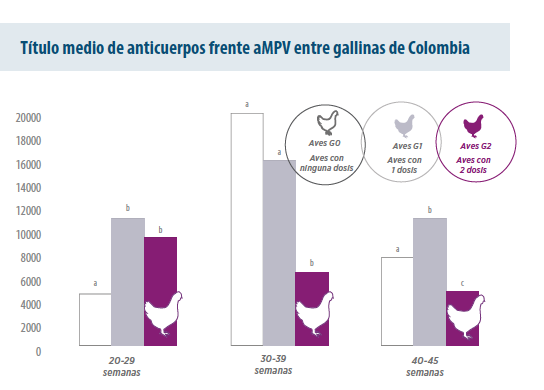
Figura 1. Título médio de anticorpos frente à aMPV dos diferentes grupos de estudo nos diferentes níveis de idade. Diferentes sobrescritos indicam diferenças significativas usando o test U de Mann-Whitney com p-valor < 0,05
As vacinas inativadas são muito importantes para as aves de ciclo longo e essenciais em situações nas quais não se permite o uso de vacinas vivas, já que são o único método de controle.
Principais funções das vacinas inativadas:
Para maximizar a eficácia dos programas vacinais frente à aMPV, nossas recomendações se apoiam em vários pilares comuns para todas as situações: Sempre começar os programas vacinais antes de existir contato com o vírus de campo. Para isso utilizar o estudo dos resultados ELISA em diferentes idades durante a criação. Aplicar as vacinas vivas diretamente sobre o tecido alvo (trato respiratório superior) via spray de gota grossa ou ocular. Para programar as idades de vacinação, não espaçar por mais de 6 semanas as aplicações entre vacinas vivas e entre vacinas vivas e inativadas.
Os programas vacinais mais habituais frente à aMPV na América Latina são aqueles que combinam vacinas vivas com vacinas inativadas, sob diferentes esquemas em função do país e das condições epidemiológicas.
Programas de 2 a 3 doses de vacina viva, mais uma dose de vacina inativada antes da transferência para granjas de produção. Programas de 1 dose de vacina viva, mais uma dose de vacina inativada antes da transferência para granjas de produção.
Existem pontos de vista muito particulares que poderiam ser acrescentados ao comentado anteriormente e que são totalmente dependentes do tipo de ave objeto do programa vacinal, como por exemplo:
Frangos de corte
Se utiliza a vacinação como ferramenta preventiva, sazonalmente durante a época do ano com maiores problemas, ou de forma continuada em áreas comprovadamente com muita circulação vírica.
Perus de corte
Se trabalha entre 2 a 3 doses em função do manejo e forma de produção. Este tipo de ave é muito mais suscetível ao vírus, o que leva a se trabalhar com períodos entre vacinas vivas muito mais curtos (10 a 21 dias). Deve-se identificar o status sanitário dos rebanhos em relação ao vírus da enterite hemorrágica para evitar problemas imunodepressores nos perus e, portanto, perda de eficácia do programa vacinal.
A avaliação do desafio pode facilmente ser realizada por avaliação sorológica ELISA: as vacinas vivas com baixa soroconversão podem ser utilizadas para avaliar quando existe uma circulação vírica alta e, em função dos resultados, adaptar o programa vacinal de uma estratégia sazonal a uma contínua, ou vice-versa. Está demostrado por vários autores que as vacinas vivas são eficazes independentemente da soroconversão que produzam (Cook et al. 1989; Williams et al. 1991; Ganapathy & Jones, 2007; S.Corella et al. 2015) já que a imunidade produzida é principalmente local, celular e humoral. (Cook et al. 1989; Williams et al. 1991; Jones et al. 1992).
Outras medidas de controle
Na América Latina uma das medidas erroneamente chamadas de controle são os tratamentos antibióticos profiláticos, assim como os curativos quando aparecem os quadros bacterianos secundários. Nas enfermidades víricas os tratamentos com antibióticos só servem para limitar os efeitos das infecções bacterianas secundárias, de tal maneira que o controle da TRT ou SHS deve se dar mediante a vacinação, biosseguridade e proporcionando aos animais o máximo conforto.
Os tratamentos com antibióticos se mostram eficazes durante a aplicação, porém os processos bacterianos rapidamente ressurgem, uma vez retirado o tratamento, já que a causa principal não foi solucionada (a aMPV)
Benefícios da racionalização de antibióticos
A HIPRA proporciona as ferramentas necessárias para poder apoiar a indústria avícola latino-americana no diagnóstico e controle da aMPV
O controle do Metapneumovírus aviário não é excessivamente complicado, sempre que os programas de controle sejam apoiados por um correto diagnóstico, programação vacinal e acompanhamento dos lotes vacinados.
Atualmente a inclusão das vacinas frente à aMPV na América Latina é variável em função do país, existindo altas porcentagens de aves vacinadas em países como Peru, Colômbia, Equador, Brasil, Venezuela…etc. Em outros países se começou com as reprodutoras pesadas, porém a vacinação de poedeiras e frangos é menor ou inexistente (República Dominicana, Chile ou Argentina). Por último, países onde se está começando com os programas de controle em reprodutoras pesadas há menos de 3 anos (México, El Salvador, Guatemala).