27 maio 2022
Salmonella: Métodos de detecção
As contaminações com Salmonella podem ser uma ameaça séria tanto para as aves como para a saúde pública dos humanos. Qualquer que seja a estratégia de intervenção para controle, redução ou erradicação, o esforço deve começar sempre pela detecção da Salmonella.
As contaminações com Salmonella podem ser uma ameaça séria tanto para as aves como para a saúde pública dos humanos.

As metodologias de detecção variam de acordo com a espécie bacteriana que se deseja detectar.



SALMONELLA PULLORUM (SP) & S. GALLINARUM (SG)
Estas duas bactérias são próprias da espécie e são microrganismos patógenos para as aves. Ambas podem ser devastadoras para a indústria avícola, de tal forma que a detecção destes microrganismos é crítica.
O foco com ambos tipos de bactérias deve ser sempre a busca nas próprias aves, seja nos reprodutores ou na prole.
| Tanto SG quanto SP podem causar infecções sistêmicas, de forma que as amostras para culturas devem incluir:
|
É comum que os órgãos e tecidos que representam cada um destes sistemas sejam agrupados para a cultura em “pools” de órgão por cada ave.

Então, as culturas devem ser incubadas a uma temperatura estável de 37°C por 24 horas, observando o crescimento bacteriano.



| SG e SP não são tão tolerantes a altas temperaturas como outras espécies de salmonela. Por isso, não devem ser cultivadas a 42°C durante as primeiras 24 horas antes de serem inoculadas em placas de cultura ligeiramente seletivo. Em contraponto, nas culturas de salmonelas móveis, a incubação se realiza a 42°C nas primeiras 24 horas. |

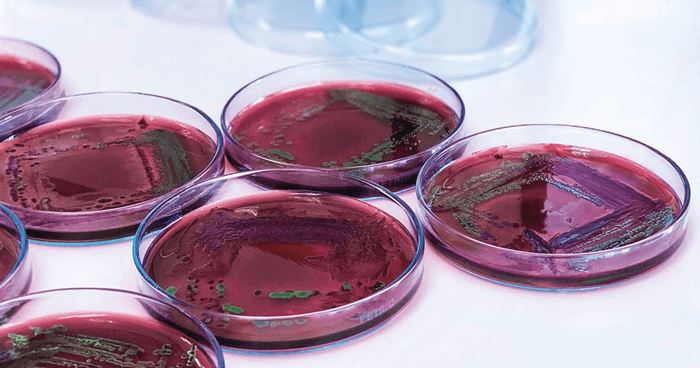
Mas no caso de estar buscando outras espécies de salmonela como S. enteritidis (SE), deve-se adicionar cultura em placas de ágar XLT4 (Xilosa, Lisina, Tergitol).


Lembre-se que estes sorotipos não reagem quimicamente como qualquer outra salmonela.
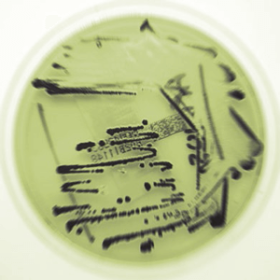
A determinação do sorotipo é um passo crítico na avaliação preliminar das colônias suspeitas.
Uma bactéria pertencente ao sorogrupo D1, e que não é móvel, deve ser uma causa de grande preocupação e deve ser identificado rapidamente utilizando provas bioquímicas e serológicas para confirmar ou descartar a possibilidade de SG ou SP.

Em nosso laboratório temos feito estudos de efetividade utilizando um isolado de SP e dois isolados derivados de aves do “quintal”.

OUTROS SEROTIPOS
Em geral, qualquer outro sorotipo de salmonela que não seja nem SG nem SP, geralmente, não será patogênica a aves comerciais.

No entanto, está não é a regra, por que salmonelas moveis, muito raramente, produziram enfermidades nas aves, com exceção da SE, que pode causar alta mortalidade com septicemia em pintinhos recém-nascidos.
Com a salmonela móvel, o foco deve estar nas questões de saúde pública. O objetivo neste caso é monitorar e detectar Salmonella para que medidas de intervenção e outros controles possam ser aplicados. Para assim, reduzir a carga de Salmonella e o risco para a saúde pública, diminuindo a incidência de infecções gastrointestinais.

AMOSTRAS DE GRANJAS E DE INCUBADORAS

Os protocolos de isolamento para Salmonela a partir destes tipos de amostra se manejam sob dois diferentes formatos:

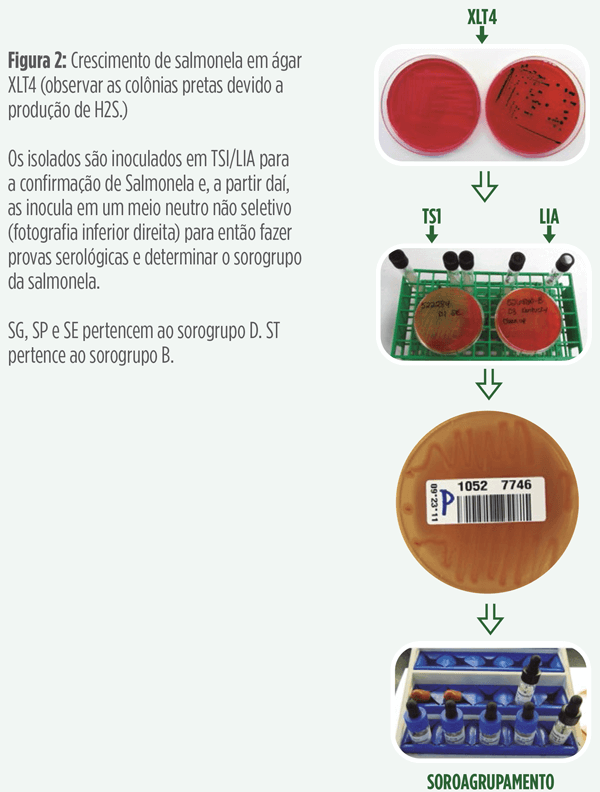
Uma amostra é obtida com uma “alça bacteriológica” do perímetro do círculo de crescimento para inoculação com outros meios de cultura (TSI/LIA, XLT4 e BGN), como mostra a figura 2.
O método aprovado atualmente por parte do programa nacional de melhoramento avícola (NPIP) consiste em:
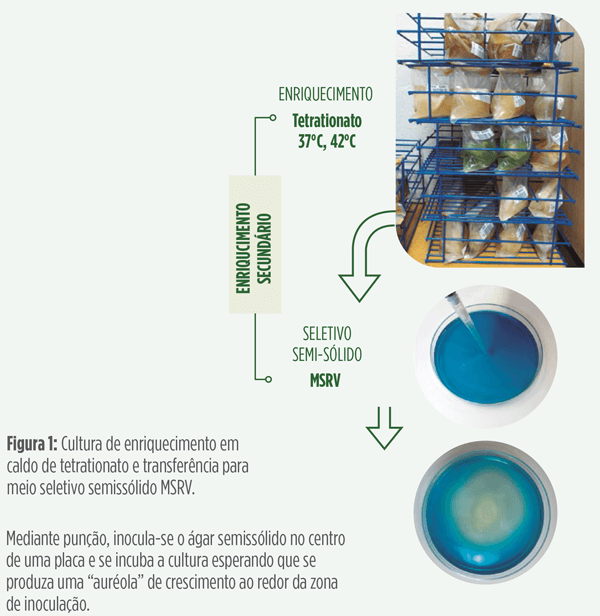
| A – Enriquecimento da amostra em um caldo de tetrationato incubado a 37°C durante 24 horas. |
| B – Depois desta primeira incubação, 100 microlitros devem ser inoculados, mediante punção, no centro de uma placa de ágar semissólido MSRV. |
| C – A placa é observada para detectar uma zona de migração das bactérias, a partir do ponto central de inoculação. |



| D – Depois de 48 horas de incubação, caso exista uma zona de migração, se insere uma “alça bacteriológica” na periferia da zona de crescimento em ágar MSRV, para logo inocular com a “alça” ágares BGN y XLT4. |
| E – Estes dois ágares são incubados a 37ºC durante 24 horas. |
| F – As placas são observadas buscando detectar colônias suspeitas de salmonela. |
| G – De três a cinco colônias suspeitas são selecionadas para serem examinadas e determinar se se trata de salmonela. |
Tipicamente, este tipo requer a inoculação de amostra destas colônias em meios TSI e LIA.

Pode-se utilizar outras placas de ágar seletivo sempre e quando sejam equivalentes as descritas ou melhores. Há outras maneiras de examinar as culturas além dos meios TSI/LIA, sempre e quando os métodos alternativos não comprometam a sensibilidade do sistema.

Outro método comum envolve o pré-enriquecimento da amostra em água peptonada incubada a 37 °C por 24 horas e, em seguida, transferir a amostra para um ou mais meios de enriquecimento seletivos.
Um mililitro da cultura enriquecida pode ser transferido para tetrationato (TT) e/ou 100 µl transferidos para RV ou MSRV.


AMOSTRAGEM EM PLANTAS DE PROCESSO
Nos Estados Unidos, utiliza-se um método de cultura a partir de lavagens de carcaças de frango completas. Muito recentemente, foi introduzida uma metodologia que exige a inclusão de partes de frango moídas.
O método do Departamento de Agricultura dos Estados Unidos (USDA) através do Serviço de Segurança e Inspeção de Alimentos (FSIS) consiste em pré-enriquecer a amostra em água peptonada seguido de enriquecimento em caldo TT e RV.

AMOSTRAGEM DE OVOS
Nos Estados Unidos, a FDA estabeleceu requisitos para frangos em crescimento e poedeiras comerciais.
O ambiente dos galpões deve ser amostrado nas 16 semanas e depois entre 40 e 45 semanas de idade para procurar especificamente por Salmonella enteritis.
Um número equivalente de ovos é amostrado a cada duas semanas em quatro ocasiões diferentes. |
Se os ovos forem negativos durante as quatro rodadas de amostragem, então o lote de aves volta a ser parte da categoria de “Sem Salmonela”.

Se algum dos grupos de ovos positivar para Salmonella enteritidis, então há duas alternativas:


A FDA estabeleceu metodologias como esta, mas também concedeu equivalência a outras metodologias semelhantes.
Dr. Waltman é Diretor Técnico do Departamento de Bacteriologia da Rede de Laboratórios de Aves do Estado da Geórgia (GPLN); Gerente de Suporte Técnico e GPLN Logística; e Representante Regional do NPIP (Programa Nacional de Melhoramento Avícola).