O PNSA estabelece, em legislação própria, as normas de qualidade para a avicultura industrial, para o controle das doenças de impactos econômicos e sociais mais importantes [3].
26 set 2017
Salmoneloses
As salmoneloses mais importantes no que tange à saúde das aves da avicultura industrial (galinha e peru) são o tifo aviário (Salmonella Gallinarum) e a pulorose (Salmonella Pullorum).
Salmoneloses são infecções por bactérias do gênero Salmonella. As salmoneloses mais importantes no que tange à saúde das aves da avicultura industrial (galinha e peru) são o tifo aviário (Salmonella Gallinarum) e a pulorose (Salmonella Pullorum). Ambas foram erradicadas da genética das galinhas e dos perus industriais, tendo em vista as doenças graves que causam nessas espécies.
Atualmente, ambas são consideradas sorovariedade única S. Gallinarum-Pullorum (SGP) [4]. O Programa Nacional de Sanidade Avícola (PNSA) determina a norma sanitária para aves industriais, galinhas, perus e outras espécies no Brasil [3].
As sorovariedades de maior importância à saúde pública são Salmonella Typhimurium e S. Enteritidis e também alvo de controle oficial. Em humanos, outras sorovariedades estão adquirindo relevância, como S. Newport [3].
As salmoneloses podem resultar em doença superaguda ou crônica em aves de todas as idades. As galinhas de subsistência ou de fundo de quintal são comumente infectadas, e, por sua rusticidade, algumas podem sobreviver em surtos de tifo e pulorose, podendo permanecer portadoras, com transmissão via transovariana para a progênie.
As salmonelas do grupo paratifo são móveis e transmitidas através da casca do ovo contaminado [17]. Há pouco e quase nenhum significado de SGP em saúde pública. Em 10 anos, entre 1982-1992, de mais de 458.000 isolados de Salmonella de toxi-infecção alimentar em humanos, apenas 26 foram identificados como SGP [3].
Etiologia
As salmoneloses são doenças causadas por bactérias do gênero Salmonella, sendo, em aves domésticas, mais importante a sorovariedade Salmonella Gallinarum-Pullorum, causadora do tifo aviário, doença septicêmica de adultos, e pulorose, doença septicêmica de pintinhos ou peruzinhos após a eclosão. Salmonella Arizonae causa doença semelhante à pulorose em pintinhos e peruzinhos.
Entre as infecções por outras sorovariedades (grupo paratifo), têm especial importância Salmonella typhimurium (S. Typhimurium) e S. enteritidis (S. Enteritidis), por sua ocorrência em toxi-infecções alimentares em humanos e com pouco ou apenas leve impacto clínico em
aves antes das duas semanas de idade. Entre as milhares de sorovariedades (>2.500) de Salmonella, todas podem ter alguma importância em saúde pública, por infectarem a ave e o produto avícola de consumo humano, carne e ovos, especialmente de plantéis sem adequada monitoração [2, 3, 4, 13, 17].
Nos produtos de consumo de aves industriais, a tolerância é zero e todas as partidas são amostradas para o gênero Salmonella, juntamente com outros gêneros importantes, como Campylobacter, Escherichia, e Listeria [3].
Classificação
As salmonelas pertencem à família Enterobacteriaceae, gênero Salmonella, em homenagem ao bacteriologista veterinário Daniel E. Salmon, do United States Department of Agriculture (USDA). São bastonetes Gramnegativos aeróbios e anaeróbios facultativos e, em sua maioria, móveis por flagelos, com exceção da sorovariedade Gallinarum-Pullorum, que é imóvel, não possuindo flagelos.
A espécie Salmonella enterica contém seis subespécies, sendo importante para aves a subespécie de animais de sangue quente, S. enterica enterica. Estão listadas no PNSA Salmonella enterica enterica sorovariedade Pullorum (S. Pullorum), S.e.e. sorovariedade Gallinarum (S. Gallinarum), S.e.e. Typhimurium (S. Typhimurium) e S.e.e. Enteritidis (S. Enteritidis). Mais de 2.500 sorovariedades foram caracterizadas, e o número continua crescendo.
Algumas sorovariedades são hospedeiro–específicas, e muitas ocorrem em múltiplos hospedeiros, embora todas sejam patógenos potenciais de humanos. O PNSA determina a vigilância e a erradicação de focos de Salmonella enterica enterica sorovariedade Pullorum (S. pullorum),
S.e.e. sorovariedade Gallinarum (S. gallinarum), S.e.e. Typhimurium (S. typhimurium) e S.e.e. Enteritidis (S. enteritidis) [3]. Houve a recente unificação de S. Gallinarum e S. Pullorum na sorovariedade S. Gallinarum-Pullorum (SGP) [13, 17].
Transmissão e doença
A pulorose (S. Pullorum) e o tifo aviário (S. Gallinarum) são doenças septicêmicas principalmente das espécies das galinhas (postura e corte) e dos perus. Embora outras espécies de hospedeiros tenham sido descritas, como a codorna, o faisão, a galinha- d’angola e o pavão, a sorovariedade GallinarumPullorum é considerada muito restrita aos hospedeiros principais, com rara manifestação clínica em outras espécies [17].
A transmissão de pulorose e tifo pode ser vertical e horizontal. No ovário, há infecção transovariana de folículos, que resulta em anomalias foliculares com número crescente de folículos alterados, embora se mantenham folículos normais por um longo período de transmissão.
A pulorose é forma septicêmica de aves jovens e tem forte associação com a infecção transovariana na fêmea infectada. A fêmea transmissora é principalmente assintomática na fase de transmissão. A detecção de anticorpos por soroaglutinação rápida com antígeno colorido [15] foi a metodologia de detecção da infecção em galinhas portadoras iniciada no final dos anos 1930, em uma época em que pulorose era devastadora, com até 100% de mortalidade nos Estados Unidos.
A pulorose foi primeiramente denominada diarreia branca bacilar, pela presença de diarreia branca, aderência de fezes brancas ao redor
e na cloaca e pela presença de bastonete bacteriano. A gravidade de pulorose e a inviabilização da avicultura forçaram a criação de planos de erradicação nos Estados Unidos da América [7, 15], sendo logo ampliados para combater também o tifo aviário.
As salmonelas causadoras de doença em aves domésticas S. gallinarum (ou S. Gallinarum) e S. pullorum (ou S. Pullorum) têm transmissão transovariana, principalmente por infecção do óvulo durante a ovulação para o infundíbulo. A galinha portadora pode transmitir S. pullorum para 1/3 da progênie (via vertical de transmissão). O pintinho que eclode infectado por S. pullorum transmite a infecção no nascedouro e, durante a cria, via fecal-oral (via horizontal de transmissão).
Progênies infectadas no ovário/infundíbulo (via vertical) apresentam clinicamente pulorose septicêmica desde o primeiro dia de vida, com infecção sistêmica, fraqueza, prostração, diarreia, desidratação e tampão de fezes na cloaca. A transmissão horizontal para os demais em convívio resulta no surgimento da doença generalizada em poucos dias [13, 17].
O tifo aviário é a forma septicêmica em adultos, caracterizada pela morte súbita de aves de aspecto prévio saudável. Apesar de o tifo aviário (S. gallinarum) poder ocorrer em jovens e seus efeitos negativos serem importantes desde a eclosão, a doença típica ocorre em adultos.
O tifo aviário pode ser doença superaguda em adultos, com a morte súbita de aves de aspecto saudável. As aves com infecção mais prolongada podem apresentar ooforite (Fig. 1), a infecção do ovário, que gradualmente as torna inférteis. Durante o processo gradual de infecção ovariana, há, entretanto, a formação de folículos normais e a geração de progênie viável, que garante a transmissão vertical.
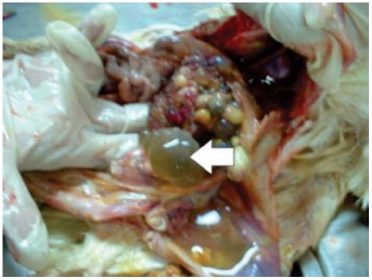
Figura 1. Ovário com degeneração folicular. Neste caso, os folículos anômalos têm cor esverdeada, deformidade e acumulação de líquido (seta).
Para aves em convívio, após a eclosão haverá a transmissão horizontal. Em ambas as salmonelas, à necrópsia, podem ser observadas esplenomegalia (Fig. 2), hepatomegalia e focos de necrose hepática (Fig. 2). O fígado pode apresentar uma tonalidade verde-escura.
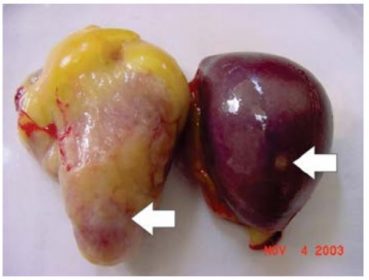
Figura 2. Coração com focos de necrose e baço aumentado. Os focos de necrose são áreas mais claras ou brancas. No baço, veem-se focos de necrose (seta).
Há pouca importância de SGP em saúde pública. Entre 1982-1992, a identificação de mais de 458.000 isolados de Salmonella de toxi-infecção alimentar em humanos nos Estados Unidos da América resultou em apenas 26 estirpes identificadas como SGP [13, 17]. As
demais salmonelas, mais de 1.400 sorovariedades do grupo paratifo, por exemplo S. Typhimurium e S. Enteritidis, são principalmente transmitidas através da casca do ovo, durante a passagem pela cloaca ou logo após a postura [13,17].
A Anvisa e o Mapa avaliam regularmente, por amostragem, a qualidade do produto de origem animal. No relatório da Anvisa de 2008, foi encontrada a presença de Salmonella (49% S. Enteritidis, 7,2% S. Typhimurium e 4,8% S. MBandaka) em 4% da carne de frango (Fig. 3) [2].
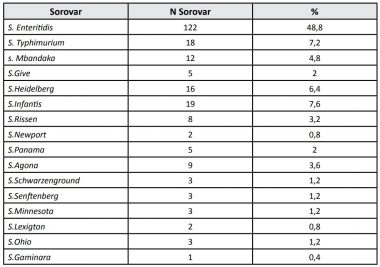
Figura 3. Ocorrência de sorovariedades de Salmonella enterica enterica em carne de frango. Relatório Prebaf, Anvisa, 2008 [2].
Fatores moleculares de virulência bacteriana estão sendo caracterizados. Por exemplo: proteínas determinantes de virulência em bactérias Gramnegativas, como as codificadas pelo gene de invA, atuam desviando processos bioquímicos celulares em favor do patógeno. Uma nanosseringa (sistema secretório de proteína tipo III – T3SS) transloca proteínas da bactéria através da membrana celular, permitindo a entrada no citoplasma de fatores de virulência celular. Em outras palavras, T3SS atua como uma seringa molecular que inocula proteínas efetoras de patogenicidade [11].
A proteção contra S. Enteritidis foi avaliada experimentalmente, sugerindo que heterófilos (granulócito polimorfo nuclear equivalente ao neutrófilo) são fundamentais no combate inicial e na redução da patogênese [10]. A proteção é mediada por peptídeos antimicrobianos, óxido nitroso e compostos oxidativos [6]. No início da infecção intestinal, a imunidade inata é ativada e desencadeia influxo de heterófilos e macrófagos para o local, reduzindo significativamente a invasibilidade da salmonela, embora podendo resultar em eventual dano autoimune.
A perda dos heterófilos pode modificar a evolução e o prognóstico, de infecção localizada no sistema gastrintestinal para doença sistêmica fatal. A invasão é um processo inflamatório, com expressão de citocinas pró-inflamatórias e quimiocinas CXCLi1 e CXCLi2 (equivalentes à IL-8 de mamíferos). O influxo intestinal de heterófilos e monócitos fagocitários resulta em inflamação e dano às vilosidades (fusão e achatamento), com secreções bacterianas SPI1 tipo III.
O reconhecimento da flagelina por TLR5 (toll-like receptor 5) é elemento chave na estimulação da imunidade inata, e sorovariedades de Salmonella sem flagelina induzem pouca inflamação [5, 8, 9, 19, 20].
Diagnóstico
A doença por SGP em jovens logo após a eclosão ou com poucos dias de idade, caracterizada por diarreia branca, com tamponamento cloacal por fezes (brancas) na pulorose, ou doença com morte aguda/superaguda em adultos no tifo aviário podem ser motivos de suspeita [13, 17].
Para o diagnóstico sorológico, as aves são testadas por soroaglutinação rápida (SRP; anticorpos no soro) (Fig. 4), e as aves reagentes (máximo de 10) são amostradas para confirmação por isolamento e identificação bacteriana. Dessas aves devem ser coletados, com material cirúrgico autoclavado, para bacteriologia, fígado, baço ovário, saco vitelino, os quais devem ser embalados separadamente em sacos plásticos ou frascos próprios e enviados em caixa isotérmica com gelo reciclável, para confirmação laboratorial [3, 13, 17].
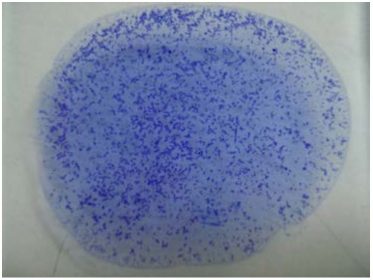
Figura 4. Reação sorológica para pulorose-tifo aviário. Soro reagente em sorologia rápida em placa com antígeno colorido (grumos roxos).
O diagnóstico de Salmonella pode ser feito pela detecção do DNA bacteriano. A amplificação de parte do gene invA, descrita primeiramente para Salmonella Typhimurium [13], em reações em cadeia pela polimerase (PCR) é considerada um método universal para a detecção do gênero (Salmonella spp.). Para a determinação da sorovariedade, o produto obtido deve ser sequenciado.
Para o diagnóstico das infecções por Salmonella de importância em saúde pública, amostras de poedeiras de ovos de consumo em estabelecimentos com galpões californianos, clássico ou modificado, por sua maior exposição ao desafio, devem ser coletados 300 gramas
de fezes frescas por galpão do núcleo, preferencialmente cecais, coletadas em diferentes pontos distribuídos ao longo do galpão e reunidas em uma única amostra.
Alternativamente, devem ser coletados quatro suabes de arrasto ou dois pares de propés, agrupados em um pool, umedecidos com meio de conservação, e cada suabe ou par de propés deve perfazer 50% da superfície do galpão. Os suabes e propés devem ser umedecidos com meio de conservação e transporte, podendo ser água peptonada tambonada 1%, meio de Cary e Blair, solução salina fisiológica ou solução de Ringer diluída a ¼ [12].
Prevenção e controle
De acordo com o PNSA, são de vigilância e erradicação obrigatórias para aves reprodutoras as salmoneloses causadas por S. pullorum, S. gallinarum, S. typhimurium e S. enteritidis [3, 12]. O tratamento e a vacinação contra as salmoneloses são proibidos para reprodutores na avicultura industrial, e o Programa Nacional de Sanidade Avícola (PNSA) determina a erradicação das quatro principais sorovariedades (S. gallinarum, S. pullorum, S. typhimurium e S. enteritidis) dos plantéis reprodutores da avicultura tecnificada, por seu impacto econômico e em saúde pública.
Entretanto, em ocasiões especiais, poderá ser utilizada a vacina contra S. enteritidis em matrizes, sob a coordenação do Mapa. Todas as estratégias de biosseguridade e monitoração devem ser implementadas para garantir a manutenção do status de livres nos plantéis comerciais.
Os estabelecimentos avícolas de postura comercial descritos na Instrução Normativa nº. 10 devem manter alojadas somente aves vacinadas, com vacinas vivas para S. Enteritidis [12]. Poedeiras comerciais de ovos de consumo humano, criadas em estabelecimentos avícolas de postura comercial com galpões do tipo californiano, clássico ou modificado, por sua maior exposição ao desafio, devem ser vacinadas contra S. Enteritidis, para a redução da infecção de ovos. A vacina viva de S. Enteritidis deve ser aplicada no incubatório ou na recria.
Todos os plantéis devem ser submetidos à vigilância epidemiológica para S. Enteritidis, S. Typhimurium e S. Gallinarum-Pullorum com coletas de amostras para testes laboratoriais [12].
O despovoamento, a eliminação de galinhas e de outras aves domésticas da propriedade e o combate permanente aos ratos são essenciais para a erradicação da doença. O combate a um surto de S. Pullorum em poedeiras vermelhas com septicemia aguda foi descrito nos Estados Unidos da América (Iowa) e pode servir de ilustração para as medidas necessárias no enfrentamento em criações de avicultura familiar. As aves foram necropsiadas, e enviados tecidos/secreções para diagnóstico laboratorial. Ratos foram capturados em armadilhas, e a presença de S. Pullorum foi demonstrada por isolamento dos intestinos.
Além da granja afetada, demonstraram-se anticorpos por SRP com sangue total e antígeno colorido em uma galinha e dois patos em granja próxima. Eletroforese de campo pulsado demonstrou semelhantes perfis de migração para S. Pullorum, indicando semelhança genética
dos isolados das galinhas, dos patos e dos ratos na granja afetada e na vizinha, possivelmente de origem comum.
A depopulação, a limpeza, o vazio sanitário e a captura de ratos permitiram a erradicação da estirpe de Salmonella Pullorum responsável [1].
Referências
1. ANDERSON LA, DA MILLER and DW TRAMPEL. Epidemiological investigation, cleanup and eradication of pullorum disease in adult chickens and ducks in two small-farm flocks. Avian Dis (2006) 50: 142-147.
2. ANVISA, Relatório de pesquisa em vigilância sanitária de alimentos. 2008. ttp://www.anvisa.gov.br/alimentos/relatorios/relatorioprebaf.
pdf.
3. BRASIL. Manual de Legislação. Ministério da Agricultura, Pecuária e Abastecimento. Programas Nacionais de Saúde Animal do Brasil. Secretaria de Defesa Agropecuária. Departamento de Saúde Animal, Brasília. 2009. http://www.agricultura.gov.br/arq_editor/file/Aniamal/Manual%20de%20Legisla%C3%A7%C3%A3o%20-%20Sa%C3%BAde%20Animal%20-%20low.pdf.
4. CDC. Centers for Disease Control and Prevention. Salmonella Surveillance, Annual Summary. (1992): Atlanta, GA, USA.
5. CHAPPELL L, KAISER P, BARROW P, JONES MA, JOHNSTON C, WIGLEY P. The immunobiologyof avian systemic salmonellosis. Vet
Immunol Immunopathol (2009) 128:53–9.doi:10.1016/j.vetimm.2008.10.295.
6. CHUAMMITRI P, OSTOJIC J, ANDREASEN CB, REDMOND SB, LAMONT SJ, PALIC D. Chicken heterophil extracellular traps (HETs):
novel defense mechanism of chicken heterophils. Vet Immunol Immunopathol (2009) 129:126–31. doi:10.1016/j.vetimm.2008.12.013.
7. EASTERN STATES CONFERENCE ON LABORATORY WORKERS IN PULLORUM DISEASE CONTROL. J Am Vet Med Assoc (1930), 77:259—263.
8. IQBAL M, PHILBIN VJ, WITHANAGE GS, WIGLEY P, BEAL RK, GOODCHILD MJ, etal. Identification and functional characterization
of chicken toll-like receptor 5 reveals a fundamental role in the biology of infection with Salmonella enteric serovar Typhimurium. Infect Immun (2005) 73:2344-50. doi:10.1128/IAI.73.4. 2344-2350.
9. KAISER P, ROTHWELL L, GALYOV EE, BARROW PA, BURNSIDE J, WIGLEY P. Differential cytokine expression in avian cells in
response to invasion by Salmonella typhimurium, Salmonella enteritidis and Salmonella Gallinarum. Microbiology (2000) 146(Pt12):3217-26.
10.KOGUT MH, TELLEZ GI, MCGRUDER ED, HARGIS BM, WILLIAMS JD, CORRIER DE, et al. Heterophils are decisive components in
the early responses of chickens to Salmonella enteritidis infections. Microb Pathog (1994) 16:141-51.
11. LILIC M, QUEZADA C.M., STEBBINS C.E.. A conserved domain in type III secretion links the cytoplasmic domain of InvA to elements of the basal body. Acta Crystallogr D Biol Crystallogr. (2010) 66 (Pt 6):709-13.
12. MAPA. Ministério da Agricultura, Pecuária e Abastecimento, Instrução Normativa nº. 10, de 11 de abril de 2013, Defesa Agropecuária,
Brasília, DF, 2013.
13. MAPA. Ministério de Agricultura, Pecuária e Abastecimento. Manual de Legislação. Programas Nacionais de Saúde Animal do Brasil. Brasília, DF, 2009. Baixado de: http://www.agricultura.gov.br/arq_editor/file/Aniamal/Manual%20de%20Legisla%C3%A7%C3%A3o%20-%20Sa%C3%BAde%20Animal%20-%20low.pdf.
14. OIE, Office International dês Epizooties. Terrestrial Manual. FOWL TYPHOID AND PULLORUM DISEASE. Chapter 2.3.1.1.Version adopted by the World Assembly of Delegates of the OIE in May 2012.
15.RAHN K, GRANDIS SA-DE, CLARKE RC, MCEWEN SA, GALAN JE, GINOCCHIO C, CURTISS R, GYLES CL. Amplification of an invA gene sequence of Salmonella typhimurium by polymerase chain reaction as a specific method of detection of Salmonella. Mol Cellular
Probes. (1992) 6:271-279.
16. REPORT OF THE CONFERENCE OF OFFICIAL RESEARCH WORKERS IN ANIMAL DISEASES OF NORTH AMERICA ON STANDARD METHODS OF PULLORUM DISEASE IN BARNYARD FOWL. J Am Vet Med Assoc (1930), 82:487-491.
17. SCHAFFER, J. M., A. D. MACDONALD, W. J. HALL, and H. BUNYEA. A stained antigen for the rapid whole blood test for pullorum disease. J Am Vet Med Assoc (1931) 79:236-240.
18. SHIVAPRASAD, H. L. Pullorum disease and fowl typhoid. In: Diseases of poultry, 11th ed. Y. M. Saif, ed. Iowa State Press, Ames, Iowa. pp. 568-582. 2003.
19. WIGLEY P, HULME S, ROTHWELL L, BUMSTEAD N, KAISER P, BARROW P. Macrophages isolated from chickens genetically resistant or susceptible to systemic salmonellosis show magnitudinal and temporal differential expression of cytokines and chemokines following Salmonella enterica challenge. Infect Immun (2006) 74:1425-30. doi:10.1128/IAI.74.2.1425-1430.
20. WIGLEY P (2014) Salmonella enterica in the chicken: how it has helped our understanding of immunology in a non-biomedical model
species. Front. Immunol. 5:482. doi: 10.3389/fimmu.2014.00482.
Material retirado de Cadernos Técnicos de Veterinária e Zootecnia, nº 76 – UFMG






















































