Conteúdo disponível em: Español (Espanhol)
Apesar do fortalecimento de medidas de biossegurança na indústria avícola comercial global, o vírus da influenza aviária (VIA) continua e continuará sendo uma das doenças respiratórias mais importantes na produção avícola.
Este vírus possui uma capacidade de variação excepcional e, por meio de mutações pontuais “drift” e recombinações “shift”, é capaz de driblar a resposta imune do hóspede e tornar-se mais efetivo no meio ambiente. A Organização Internacional de Epizootias (OIE) mantém a informação sobre os surtos de Influenza Aviária de alta patogenicidade nos países membros.
Esses surtos foram divididos em dois de 2005 a 2018.

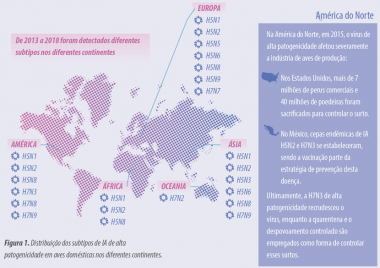
Figura 1. Distribuição dos subtipos de Influenza Aviária de alta patogenicidade em aves domésticas nos diferentes continentes.
Se compararmos os dois surtos, o número de países afetados é quase constante, da mesma forma, o número de eventos reportados é comparável. O que sim mudou é a diversidade de subtipos atuantes, os quais triplicaram (Tabela 1).
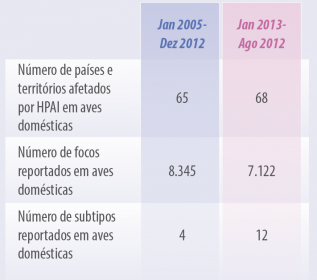
Tabela 1. Comparação entre as duas últimas panzootias de influenza aviária de alta patogenicidade. Número de eventos, países afetados e diversidade das cepas atuantes.
Os estudos relacionados com a IA voltaram-se durante anos para o estudo da relação entre o patógeno e o hóspede, estudando-se muito pouco a relação entre o patógeno e o meio ambiente avícola.
A persistência desse vírus em bandos de aves e seu meio ambiente, determina o sucesso no controle e erradicação dessa doença.
Enquanto em surtos de alta patogenicidade a biossegurança e a pronta eliminação das aves afetadas é a premissa para a erradicação, os surtos de baixa patogenicidade têm se caracterizado, nos últimos anos, por serem controlados mediante biossegurança e comercialização controlada.
Como exemplo prático, surtos de IA de baixa patogenicidade em perus na Califórnia seguem uma dinâmica similar. A seroconversão demora entre 8 e 12 dias depois de sua primeira detecção molecular. Ao cabo de 24 dias depois de sua primeira detecção, o vírus já não é detectável por RT-PCR. Esta dinâmica permite enviar essas aves ao mercado livres do vírus de baixa patogenicidade (Dr. Charles Corsiglia, Foster Farms, comunicação pessoal).

Apesar de ser um vírus envelopado, que em condições experimentais pode ser eliminado facilmente, em condições de campo e, especialmente em galpões de aves, o vírus é capaz de persistir até dois dias em cama reutilizada de frango de corte e perus, e mais de quatro dias no guano (esterco) de galinha poedeira, como foi reportado na edição da aviNews de março de 2017 e na Avian Diseases (Hauck et al., 2017).
Neste artigo vamos destacar:



Efeitos da reutilização da cama na persistência do vírus de IA de alta (HP) e baixa (LP) patogenicidade

Para isso, a cama de frango de corte, de um e onze ciclos de uso, e a cama de peru, de um e quatro ciclos de uso, foram contaminadas com 105,75 EID50 por ml de cada vírus em separado.
As camas infectadas e não infectadas (controles) foram amostradas, coletando 5 gr de cada cama, a cada 12 horas, até as 96 horas.
Detecção molecular prévia da presença do vírus em cada amostra de cama e sua quantificação por um RT-PCR quantitativo, as amostras foram processadas e inoculadas em ovos embrionados livres de patógenos específicos.
Dois dias depois da inoculação o líquido alantóide, foi obtido e o vírus detectado pela mesma técnica molecular quantitativa. Quando a quantidade de partículas virais obtidas do líquido alantóide superou a quantidade de vírus na amostra da cama, assumiu-se que o vírus se encontrava vivo e era capaz de multiplicar-se (Figura 2).
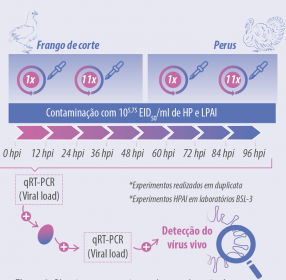
Figura 2. Planejamento experimental para a detecção de partículas virais vivas em amostras de cama contaminada.
Os experimentos que envolveram vírus de alta patogenicidade (H5N8) foram desenvolvidos em um laboratório para patógenos seletos (BSL-3) no California Animal Health and Food Safety laboratory (CAHFS). Esses experimentos foram realizados em duplicata.
Como mostra a Tabela 3, o vírus de baixa patogenicidade persistiu menos de 24 horas na cama testada, salvo na cama de frango de corte usada por um ciclo (B1), onde persistiu menos de 36 horas.
O vírus de alta patogenicidade persistiu menos de 72 horas na cama testada, salvo na amostra de cama de peru de um ciclo de uso (P1), onde persistiu menos de 60 horas.
A repetição do experimento confirmou os resultados anteriores. Como conclusão, podemos ver que o número de ciclos de uso das camas testadas parece não ter incidência na persistência do vírus da IA.
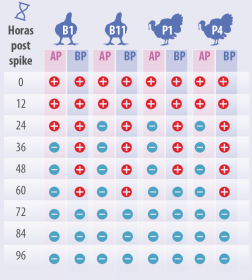
Tabela 3. Persistência do vírus de IA de alta (HP) e baixa (LP) patogenicidade, na cama de frango de corte de um ciclo (B1), onze ciclos (B11) e cama de peru de um ciclo (P1) e de quatro ciclos (P4) aos tempos de amostragem após a contaminação.
Efeitos do uso de acidificantes na cama de aves de produção, na persistência do vírus de IA de baixa patogenicidade

Usando um planejamento experimental similar ao do experimento anterior (Figura 3), testaram-se os efeitos do acidificante no vírus. Este experimento foi realizado em duplicata.

Figura 3. Grupos experimentais
O acidificante inativou as partículas virais na cama de frango de corte. O vírus de baixa patogenicidade persistiu ao menos 8 horas na cama de peru não tratada. Não foi detectado um efeito do acidificante na cama de peru, o vírus persistiu da mesma forma nos grupos com e sem acidificante (Tabela 4).
Isso pode decorrer devido à umidade na cama de peru, a qual foi consideravelmente alta comparada com a umidade da cama de frango de corte antes do experimento (~55% na cama de frango de corte comparada com ~79% na cama de peru).
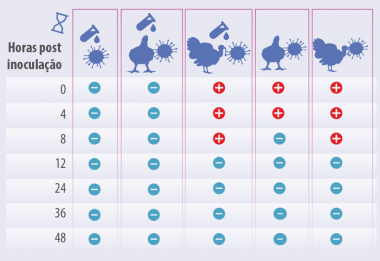
Tabela 4. Detecção de vírus vivo LP (H6N2) após o isolamento viral em ovos livres de patógenos específicos
Inativação do vírus influenza de baixa patogenicidade em mortalidade infectada e tratada com temperatura

Compostagem de frangos, cama de frango de corte e uma combinação de compostagem de frango e cama de frango de corte foram contaminados com 105 EID50/ml de IA de baixa patogenicidade (H6N2). Cada um desses substratos foi submetido a uma temperatura de 50 °C e 60 °C em um banho de água, para medir o efeito da temperatura na persistência viral. PCR quantitativo foi utilizado para determinar a quantidade de vírus antes e depois da inoculação em ovos e sua persistência (Figura 4).
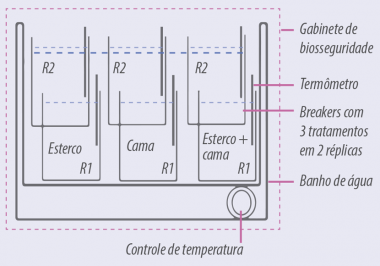
Figura 4. Planejamento do banho de água que fornece temperaturas de compostagem aos diferentes substratos contaminados com IA de baixa patogenicidade

Figura 5. Detecção de vírus vivo nos grupos compostagem de frango, compostagem de frango + cama de broiler e cama de broiler tratados a 50 °C e 60 °C

Influenza aviária de baixa patogenicidade foi detectada em todos os grupos após serem contaminados a 50 °C. Meia hora após a contaminação, o vírus vivo foi detectado somente no grupo que continha a cama de frango de corte. A 60 ºC, o vírus vivo foi detectado no momento da contaminação somente nos grupos de compostagem de frango + cama de frango de corte e cama de frango de corte. A repetição do experimento confirmou esses resultados.
CONCLUSÃO




O autor agradece ao Dr. Pramod Pandey, Beate Crossley e à estudante Alejandra Figueroa e Theodore Derksen por sua contribuição na obtenção dos resultados nestes experimentos.
Um manuscrito com mais detalhes dos experimentos reportados neste trabalho está sendo preparado para ser publicado na Avian Diseases.
🔒 Conteúdo exclusivo para usuários registrados.
Cadastre-se gratuitamente para acessar este post e muitos outros conteúdos especializados. Leva apenas um minuto e você terá acesso imediato.
Conecte-seRegistre-se em aviNews
CADASTRE-SE