14 jun 2021
Coccidiose: Efeito do gás amônia em cama aviária contaminada com Eimeria spp
A coccidiose aviária é uma doença causada pelo protozoário Eimeria spp, cujos oocistos são bastante resistentes ao meio ambiente e apresentam multiplicação rápida na cama aviária em condições favoráveis de temperatura, umidade e de aeração. Conheça aqui a importância de reduzir a carga parasitária na cama contaminada!
A coccidiose aviária é uma das enfermidades mais prevalentes na avicultura mundial, tem grande importância econômica na cadeia avícola, acarretando na elevação dos custos de produção devido às perdas zootécnicas e ao uso onipresente dos anticoccidianos.
As técnicas utilizadas para o controle da doença na criação das aves estão fundamentadas, principalmente, na utilização dos antimicrobianos via ração, que podem estar contribuindo para o aumento da resistência dos microrganismos na cadeia avícola. E, ainda, em técnicas utilizadas para o tratamento das camas aviárias contaminadas.


Coccidiose: Efeito do gás amônia em cama aviária contaminada com Eimeria spp
A coccidiose aviária é uma doença:
Continue após a publicidade.
acomete plantéis de matrizes, aves de postura e principalmente frangos de corte;
elevando a conversão alimentar, desuniformidade e queda no ganho de peso das aves.
Em relação aos custos de produção, alguns estudos estimam que o custo global para o controle da doença seja de aproximadamente 14,0 bilhões de euros por ano.

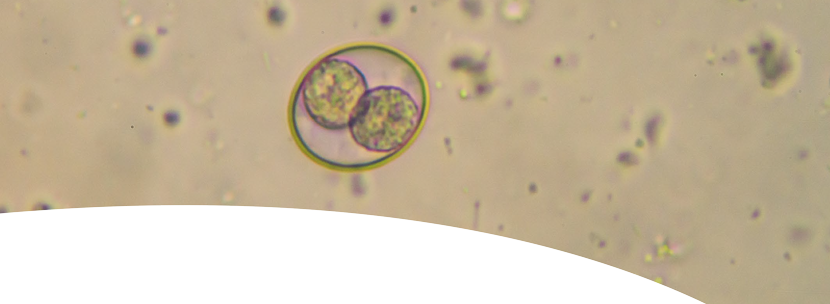
EIMERIAS SPP
As Eimerias spp são parasitas intracelulares e logo após a infecção causam danos na mucosa intestinal das aves, levando à redução da absorção dos nutrientes.

As espécies mais prevalentes no Brasil e que acometem plantéis de frangos de corte são:

E. máxima e
E. tenella;
Na maioria dos casos, observa-se a forma 
CAMA AVIÁRIA
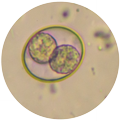
Os oocistos de Eimeria spp. são bastante resistentes ao meio ambiente e apresentam multiplicação rápida na cama aviária em condições favoráveis de temperatura, umidade e de aeração.


A amônia é um composto químico comumente utilizado nas indústrias, de grande aplicabilidade no setor de refrigeração e apresenta baixo custo para aquisição.
Na avicultura, a amônia tem origem na fermentação microbiana do ácido úrico presente na cama aviária. O ácido úrico, após sofrer ação da enzima uricase é convertido em amônia e gás carbônico.

Seu mecanismo de ação ainda não é claramente compreendido.
Sabe-se que pode atravessar a parede das células facilmente e, já no seu interior, acredita-se que o NH3 atue, elevando o pH intracelular através de influxo direto, ligações a íons de hidrogênio e no deslocamento da concentração de potássio para fora da célula, levando à desestabilidade da homeostase celular.

Figura 1: Método lona superfície com injeção de amônia controlada
Um novo método de desinfecção de cama aviária com lona na superfície e injeção de gás amônia, de forma controlada em concentrações variando de 0,2 a 1%, demonstraram eficácia na eliminação de Salmonella Heidelberg e Eimerias spp. em testes realizados in vitro e de campo.
RESULTADOS
Os resultados obtidos no experimento com as Eimerias estão demonstrados na Tabela 1.
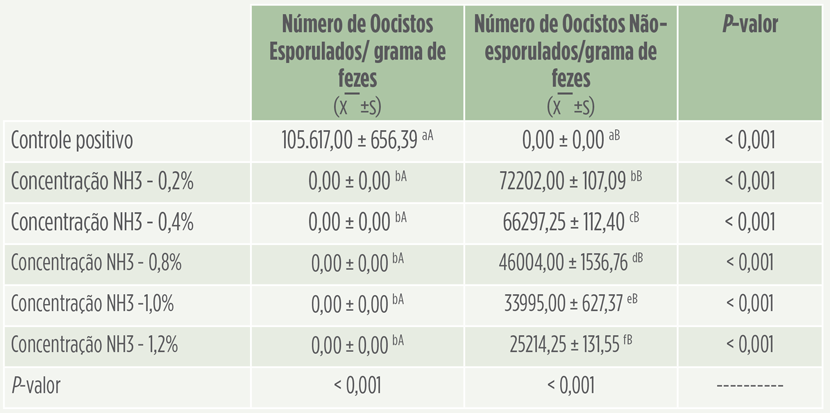
Tabela 1. Efeito desinfetante do gás amônia em diferentes concentrações em camas de aviário contaminadas com Eimeria spp. a,f Médias nas colunas não diferem pelo Teste de Dunn – post-hoc do Teste de Kruskal-Wallis (p > 0,05). A,B Médias nas linhas não diferem pelo Teste de Mann-Whitney (p > 0,05).



GÁS AMÔNIA
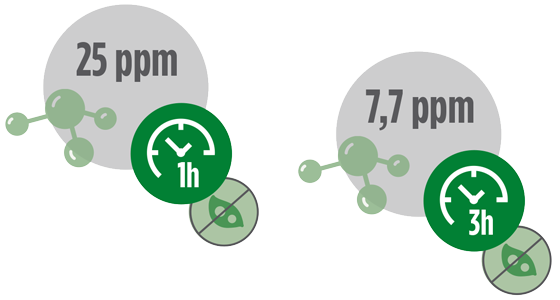
Horton-Smith et al. (1940), utilizando concentração de 25 ppm de gás amônia eliminou 100% dos oocistos em uma hora. Já em concentração de 7,7 ppm foi igualmente eficaz em período de três horas.

Ainda no mesmo estudo foi relatado que diferentes diluições de amônia líquida foram letais frente aos oocistos de Eimeria spp.

solução a 5% eliminou os oocistos em 2 horas e,
solução a 10% foi capaz de eliminar e inviabilizar os oocistos em 45 minutos.
DESINFECÇÃO DE CAMA
Lorenzoni (2020) relata a sensibilidade dos oocistos de Eimeria spp no meio ambiente, principalmente quando se encontram fora do hospedeiro por período de duas ou mais semanas.



Coccidiose: Efeito do gás amônia em cama aviária contaminada com Eimeria spp

Alguns fatores físico-químicos da cama aviária devem interagir de forma eficiente a fim de elevar a produção de amônia, que por sua vez exerce ação frente aos microrganismos (Oliveira et al., 2004; Ferreira et al., 2004; Soliman et al., 2018).


O estudo também reforça os resultados obtidos por Chapman and Johnson (1992); Assis et al. (2013), que revelaram redução significativa no número de oocistos de Eimeria acervulina quando a cama foi submetida ao tratamento de fermentação com enleiramento e lona plástica por 10 dias.
Coccidiose: Efeito do gás amônia em cama aviária contaminada com Eimeria spp
OUTRAS PESQUISAS
Outro fator importante diz respeito aos relatos de Kawazoe (2009), que indicam a resistência da parede do oocisto de Eimeria spp. à proteólise e impermeabilidade a substâncias solúveis em água, incluindo os diferentes desinfetantes comumente utilizados na cadeia avícola.

Kim e Patterson (2003) relatam que a adição da cal virgem ou hidratado sobre a cama contribui na elevação de seu pH, melhorando a ação da enzima uricase e consequentemente elevando a produção de amônia.


Desta forma, a injeção de gás amônia de forma controlada, com lona plástica sobreposta à cama é um método que poderá melhorar a desinfecção de camas reaproveitadas, isolando os parâmetros físico-químicos que interagem e interferem no processo de produção do gás amônia natural por fermentação microbiana (Mendonça et al., 2021).


Assim, o presente estudo pode colaborar no aperfeiçoamento do método lona na superfície com injeção de amônia no controle de Eimeria spp em camas aviárias reaproveitadas, e contribuir para a redução do uso de anticoccidianos, oferecendo aos consumidores um alimento mais seguro, livre de resíduos e microrganismos resistentes aos antimicrobianos.
REFERÊNCIAS
Blake, P. D., J. Knox, B. Dehaeck, B. Huntington, T. Rathinam, V. Ravipati, S. Ayoade, W. Gilbert, A. O. Adebambo, I. D. Jatau, M. Raman, D. Parker, J. Rushton, and F. M. Tomley. 2020. Re-calculating the cost of coccidiosis in chickens. Vet. Research, França. 51:115:1-14.
Chroustová, E., and K. Pinka. 1989 The Efficiency of Disinfectants on the Oocysts of Eimeria tenella. Veterinary Research Institute, EUA. 5:141-149. Disponível em: https://actavet.vfu.cz/56/1/0141/. Acesso em: 10 jun. 2020
Costa C. A. F., and D. P. Paiva. 2009. Cultivo in vivo, in vitro e diagnóstico específico de Eimeria spp. de Gallus Gallus. Brasília: Embrapa Informação Tecnológica.
Decrey, L., S. Kazama, and T. Kohn. 2016. Ammonia as an in situ sanitizer: influence of virus genome type on inactivation. Appl. Environ. Microbiol. 82:4909–4920.
Fayer R., T. K. Graczyk, M. R. Cranfield, and J. M. Trout. 1996 Gaseous disinfection of Cryptosporidium parvumoocysts. Appl Environ Microbiol. 62:3908–39.
Gehring, V. S., E. D. Santos, B. S. Mendonça, L. R. Santos, L. B. Rodrigues, E. L. Dickel, L. Daroit, and F. Pilotto. 2020. Alphitobius diaperinus control and physicochemical study of poultry litters treated with quicklime and shallow fermentation. Poult. Sci. Https:// https://www.sciencedirect.com/science/article/pii/S0032579119578361?via%3Dihub
Gordon H. M. C. L., and H. V. Whitlock. 1939. A new technique for counting nematode eggs in sheep faeces. Journal of the Council for Scientific and Industrial Research 12:50-53.
Lovato, M. 2018. Coccidiose. Páginas 141-149 em Doenças das Aves. Lovato, M., and H. F. Dos Santos. São Paulo: Kindle Direct Publishing.
Mendonça, B. S., W. R. Oliveira, R. S. Pereira, L. R. Santos, L. B. Rodrigues, E. L. Dickel, L. Daroit, and F. Pilotto. 2021. Use of ammonia gas for Salmonella control in poultry litters. Poult. Sci. 100:314-318. 10.1016/j.psj.2020.10.008.
Ojimelukwe, A. E., D. E. Emedhem, G. O. Agu, F. O. Nduka, and A. E. Abah. 2018. Populations of Eimeria tenella express resistance to commonly used anticoccidial drugs in southern Nigeria. Int Journal of Vet. Sci. and Med. 6:192- 200.
Payne, J. B., J. E. Osborne, P. K. Jenkins, and B. W. Sheldon. 2007. Modeling the growth and dead kineties of Salmonella in poultry litter as a function of pH and water activity. Poult. Sci. 86:191-201. doi:10.1093/ps/86.1.191.
Reece, F. N., B. D. Lott, and J. W. Deaton. 1980. Amônia na atmosfera durante a ninhada afeta o desempenho de filhotes de frango Poult. Sci. 59:486-488
Rosa, P. S. 2014. Cama para frangos de corte. Produção de frangos de corte, 2 ed. FACTA: Campinas. 9:153-180.
Warren, K. S. 1962. Ammonia toxicity and pH. Nature.195:47-49.